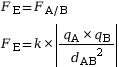Expliquer la cohésion des solides ioniques et moléculaires
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Expliquer la cohésion au sein de composés solides ioniques et moléculaires par l’analyse des interactions entre entités.
- La cohésion d’un solide ionique est assurée par l’interaction électrostatique attractive entre un cation et un anion.
- La cohésion des solides moléculaires est assurée par les interactions de van der Waals et par les liaisons hydrogène dans certains cas.
- La liaison hydrogène est une interaction attractive qui n’existe que pour certaines molécules qui possèdent un atome d’hydrogène lié à un atome très électronégatif et porteur d’au moins un doublet non liant.
- Atome et ion
- L’interaction électrostatique
- La formule d’une molécule
Le chlorure de sodium solide NaCl(s) est un solide ionique constitué d’ions sodium Na+ et chlorure Cl−.

Structure du chlorure de sodium solide
Les ions exercent les uns sur les autres des forces électrostatiques qui sont attractives si les charges électriques des ions sont de signes opposés et répulsives si les charges électriques des ions sont de même signe.
L’expression de la valeur de cette force électrostatique est la suivante.
|
|
avec :
|
- La double barre signifie qu’il s’agit d’une valeur absolue. En mathématiques, la valeur absolue d’un nombre correspond à sa valeur sans tenir compte de son signe.
- Cette expression est aussi appelée loi de Coulomb.
Les distances entre les ions sont parfois exprimées en nanomètre (nm). Pour appliquer la formule précédente, il faut alors penser à réaliser la conversion suivante : 1 nm = 1 × 10−9 m.
On étudie le chlorure de sodium solide NaCl(s), lequel est un solide ionique constitué d’ions sodium Na+ et chlorure Cl−.
On va étudier les forces électrostatiques entre les différents ions qui constituent ce solide ionique, afin d’expliquer sa cohésion.
Dans cette structure, les distances entres les différents ions les plus proches sont les suivantes.
| Distance d entre deux ions sodium | Distance d entre deux ions chlorure | Distance d entre un ion sodium et un ion chlorure |
| 3,93 × 10−7 m | 3,93 × 10−7 m | 2,78 × 10−7 m |
On calcule les forces électrostatiques pour chaque paire d’ions.
L’ion sodium Na+ porte une charge
électrique élémentaire positive
donc ![]() 1,60 × 10−19 C
et l’ion chlorure Cl− porte
une charge électrique élémentaire
négative donc
1,60 × 10−19 C
et l’ion chlorure Cl− porte
une charge électrique élémentaire
négative donc ![]() −1,60 × 10−19 C.
−1,60 × 10−19 C.
| Force F exercée entre deux ions sodium | Force F exercée entre deux ions chlorure | Force F exercée entre un ion sodium et un ion chlorure |
| 1,49 × 10−15 N | 1,49 × 10−15 N | 2,98 × 10−15 N |
On constate que la valeur de la force électrostatique attractive entre un cation et un anion est environ deux fois supérieure à celles des forces répulsives entre deux cations ou deux anions :
![]()
On en conclut que c’est la force électrostatique attractive entre les cations et les anions qui est responsable de la cohésion du solide ionique.
La glace est un solide moléculaire constitué de molécules d’eau H2O.
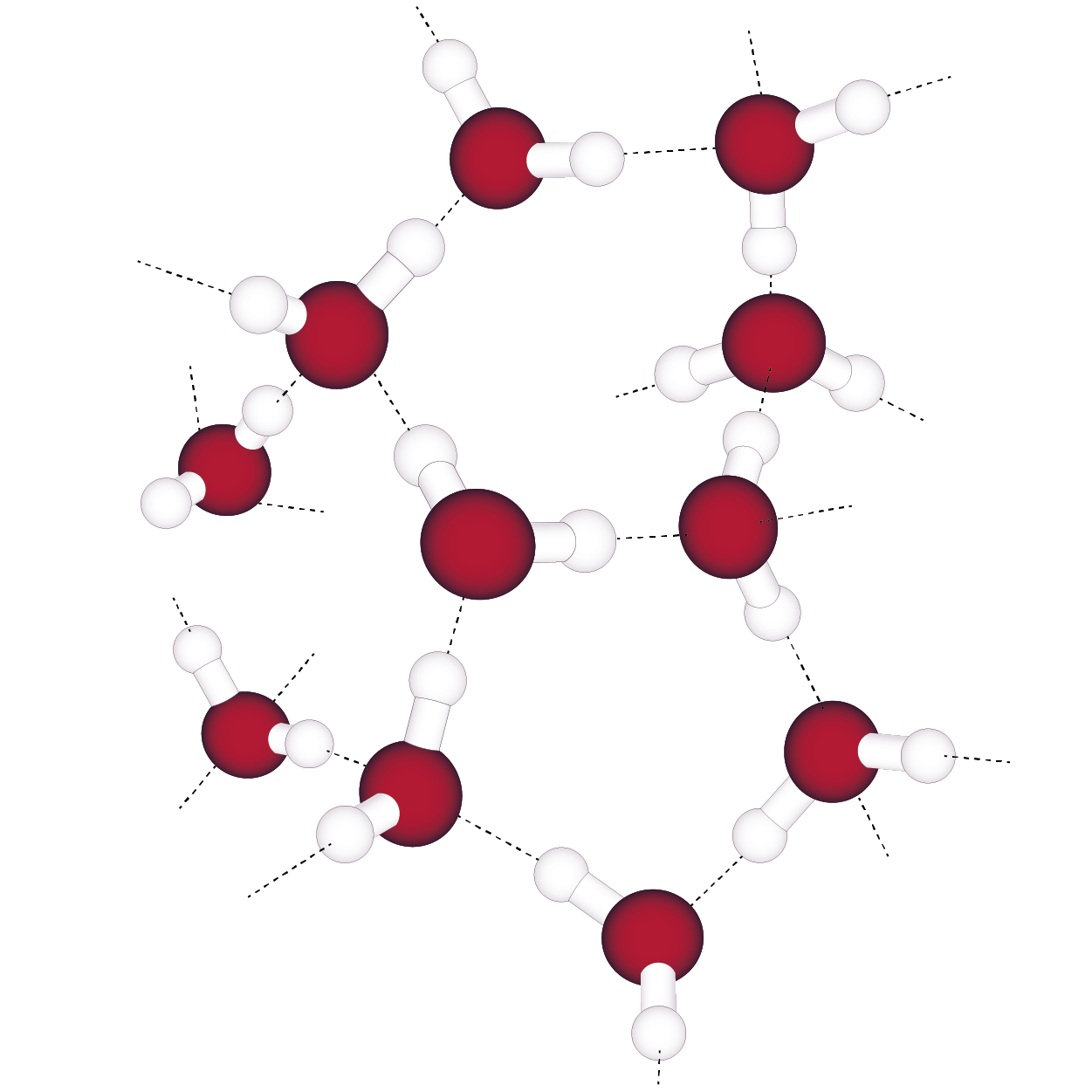
Structure de la glace (eau solide)
- Les interactions de van der Waals sont des interactions électrostatiques attractives qui existent toujours entre les molécules.
- Les liaisons hydrogène sont des
interactions électrostatiques attractives qui
n’existent que pour un certain type de
molécules.
Une liaison hydrogène s’établit entre un atome d’hydrogène de la première molécule, lié à un atome très électronégatif, et un atome très électronégatif porteur d’au moins un doublet non liant de la deuxième molécule.
Les atomes très électronégatifs et porteurs de doublets non liants sont le plus souvent l’oxygène O (2 doublets non liants et
Dans le solide suivant composé de 2 molécules d’eau, la cohésion entre les deux molécules est assurée par la liaison hydrogène.

Liaison hydrogène entre deux molécules d’eau
Les liaisons hydrogène sont plus fortes que les interactions de van der Waals.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !