Étudier des expériences qui mettent en jeu une réaction d'oxydoréduction
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Expliquer des expériences en étudiant les réactions d’oxydoréduction associées.
- Les réactions d’oxydoréduction consistent en un transfert d’électron(s) d’un réducteur vers un oxydant.
- L’oxydant est réduit, le réducteur est oxydé.
- L’avancement de la réaction peut se déduire à partir de la formation d‘un produit ou de la disparition d’un réactif coloré ou gazeux.
- Couple oxydant/réducteur
- Demi-équation électronique : oxydation, réduction
Une réaction d’oxydoréduction repose sur
un transfert d’électron(s) entre
2 réactifs : l’un s’oxyde
pendant que l’autre est réduit.
Cet échange d’électron(s) est à la
base de divers phénomènes observables
expérimentalement.
Voici deux expériences qui mettent en jeu cet échange d’électrons.
Dans un bécher, on verse une solution de sulfate de cuivre (CuSO4) et on plonge une lame de zinc (Zn).

Lame de zinc plongée dans une solution de sulfate de cuivre
Après plusieurs minutes, on observe que la partie immergée de la lame de zinc se recouvre progressivement d’un dépôt rouge de cuivre.
La solution change de plus de couleur.

Résultat de l’expérience après plusieurs minutes
Il est possible d’expliquer ces observations en étudiant la réaction d’oxydoréduction associée à cette expérience.
Il faut suivre les étapes suivantes pour écrire l’équation associée à cette réaction d’oxydoréduction.
-
Identifier les 2 réactifs de cette
réaction
d’oxydoréduction.
Les 2 réactifs de cette réaction sont le zinc à l’état solide (Zn(s)) et le cuivre sous forme ionique (Cu2+).
L’ion sulfate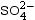 n’intervient pas car c’est un ion
spectateur.
n’intervient pas car c’est un ion
spectateur.
Ces 2 éléments appartiennent aux 2 couples Cu2+/Cu et Zn2+/Zn. -
Identifier l’oxydant et le réducteur
de cette réaction
d’oxydoréduction, puis écrire les
demi-équations associées.
- L’ion cuivre Cu2+ étant
un oxydant, il capte les électrons
en subissant une réduction selon
l’équation :
Cu2+(aq) + 2e– = Cu(s). - Le zinc Zn étant le réducteur, il
cède les électrons en subissant
une oxydation :
Zn(s) = Zn2+(aq) + 2e–.
- L’ion cuivre Cu2+ étant
un oxydant, il capte les électrons
en subissant une réduction selon
l’équation :
-
Additionner les 2 demi-équations pour
obtenir l’équation
d’oxydoréduction.
Ces 2 demi-équations font intervenir le même nombre d’électrons (2), on peut donc directement les additionner.
Cu2+(aq) + 2e– + Zn(s) = Zn2+(aq) + 2e– + Cu(s)
-
Simplifier tous les éléments
répétés à gauche et
à droite de cette équation.
On simplifie par les 2e– qu’on retrouve de chaque côté et on obtient l’équation d’oxydoréduction de cette réaction.
Cu2+(aq) + Zn(s) = Zn2+(aq) + Cu(s)
L’équation d’oxydoréduction associée à cette expérience permet d’expliquer les observations réalisées.
- Les ions Cu2+ disparaissent dans l’équation d’oxydoréduction, or les ions Cu2+ sont bleus en solution : on justifie ainsi la perte de la teinte bleue de la solution (les ions Zn2+ apparaissent mais ils sont transparents).
- Il y a apparition du cuivre solide Cu(s) dans l’équation d’oxydoréduction, or le cuivre solide est de couleur rouge : on explique ainsi le dépôt de cuivre sur la plaque de zinc.
Dans un tube à essai, on verse une solution
d’acide chlorhydrique (H+ + Cl–)
et on rajoute de la poudre de fer (Fe).
On bouche ensuite le tube à essai.
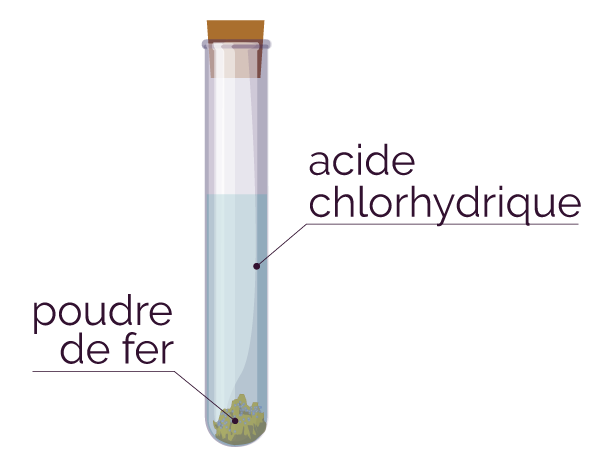
Schéma de l’expérience
Après plusieurs minutes, on observe que des bulles apparaissent sur la poudre de fer. La solution devient légèrement verte.
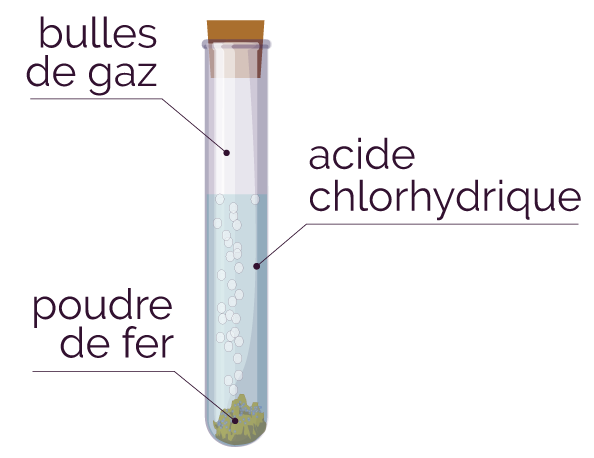
Résultat de l’expérience
Il est possible d’expliquer ces observations en étudiant la réaction d’oxydoréduction associée à cette expérience.
Il faut suivre les étapes suivantes pour écrire l’équation associée à cette réaction d’oxydoréduction.
-
Identifier les 2 réactifs de cette
réaction
d’oxydoréduction.
Les 2 réactifs de cette réaction sont le fer à l’état solide (Fe(s)) et l’ion H+ qui provient de l’acide chlorhydrique (H+ + Cl–).
Ces 2 éléments appartiennent aux 2 couples : Fe2+/Fe et H+/H2. -
Identifier l’oxydant et le réducteur
de cette réaction
d’oxydoréduction, puis écrire les
demi-équations associées.
- L’ion H+ étant
un oxydant, il capte les électrons en
subissant une réduction selon
l’équation :
2H+(aq) + 2e– = H2(g)Remarque
Cette équation est équilibrée avec les charges et les éléments atomiques. - Le fer Fe étant le réducteur, il
cède les électrons en subissant une
oxydation :
Fe(s) = Fe2+(aq) + 2e–
- L’ion H+ étant
un oxydant, il capte les électrons en
subissant une réduction selon
l’équation :
-
Additionner les 2 demi-équations pour
obtenir l’équation
d’oxydoréduction.
Ces 2 demi-équations font intervenir le même nombre d’électrons (2), on peut donc directement les additionner.
2H+(aq) + 2e– + Fe(s) = Fe2+(aq) + 2e– + H2(g)
- Simplifier tous les éléments
répétés à gauche et
à droite de cette équation.
On simplifie par les 2e– qu’on retrouve de chaque côté et on obtient l’équation d’oxydoréduction de cette réaction.2H+(aq) + Fe(s) = Fe2+(aq) + H2(g)
L’équation d’oxydoréduction associée à cette expérience permet d’expliquer les observations réalisées.
Les ions Fe2+ apparaissent dans l’équation d’oxydoréduction, or ces ions sont vert pâle en solution : on justifie ainsi la coloration verte de la solution.
Le dihydrogène gazeux H2 apparait dans l’équation d’oxydoréduction, ce qui explique la formation de bulles.
Pour prouver qu’il s’agit bien de ce gaz, on peut effectuer le test caractéristique qui consiste à déboucher le tube à essai et à présenter immédiatement une allumette enflammée.
La détonation « pop » prouve la présence de H2(g).

Test caractéristique de présence du dihydrogène

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








