Établir le schéma de Lewis et la géométrie d'une molécule
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Établir le schéma de Lewis de molécules à partir du tableau périodique.
- Interpréter la géométrie d’une entité à partir de son schéma de Lewis.
- Les atomes, en réalisant des liaisons, partagent les électrons de leur couche de valence afin d’avoir la structure électronique stable des gaz nobles.
- Le schéma de Lewis des atomes permet de trouver le schéma de Lewis de la molécule, par application de la règle de l’octet ou du duet.
- Le schéma de Lewis d’une molécule permet de déterminer sa géométrie.
- Le nombre de doublets liants et non liants permet de déterminer la géométrie d’une molécule simple.
- Les règles du duet et de l'octet
- Composition et neutralité d'un atome
- La structure électronique d'un atome
- La formule développée d'une molécule
Les gaz nobles possèdent une très grande stabilité chimique : ils réagissent très peu avec d’autres éléments chimiques.
Cette grande stabilité est expliquée par la configuration électronique particulière de chacun de ces gaz nobles.
Le tableau ci-dessous montre la configuration électronique de 3 gaz nobles.
| Nom | Hélium | Néon | Argon |
| Symbole | He | Ne | Ar |
|
Configuration électronique |
1s2 | 1s22s22p6 | 1s22s22p63s23p6 |
|
Nombre
d’électrons dans l’atome |
2 | 10 | 18 |
La couche de valence ![]() de l’atome
d’hélium (
de l’atome
d’hélium (![]() ) possède deux
électrons de valence (duet) tandis que les
couches de valence des atomes de néon (
) possède deux
électrons de valence (duet) tandis que les
couches de valence des atomes de néon (![]() ) et d’argon (
) et d’argon (![]() ) possèdent huit
électrons de valence (octet).
) possèdent huit
électrons de valence (octet).
- La configuration électronique d’un atome dans son état fondamental indique la répartition des électrons dans les couches et les sous-couches.
- La couche de valence correspond à la
dernière couche
électronique
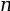 qui contient des
électrons.
qui contient des
électrons.
Les atomes perdent, gagnent ou partagent des électrons de valence de manière à obtenir la même configuration électronique que celle des gaz nobles, c’est-à-dire une configuration électronique de valence en duet (telle que celle de l’hélium) ou en octet (telle que celle du néon ou de l’argon).
Dans une molécule, les atomes mettent des
électrons de valence en commun avec
d’autres atomes afin d’obtenir la
configuration électronique de valence en duet ou
en octet.
La mise en commun de deux électrons de valence
par deux atomes permet la réalisation
d’une liaison chimique.
Le tableau suivant indique le nombre de liaisons chimiques que chaque atome doit réaliser pour respecter la règle du duet ou de l’octet. Ce nombre de liaisons dépend de la configuration électronique de l’atome étudié.
| Atome | Symbole | Configuration électronique | Nombre de liaisons chimiques |
| Hydrogène | H | 1s1 | 1 |
| Carbone | C | 1s22s22p2 | 4 |
| Azote | N | 1s22s22p3 | 3 |
| Oxygène | O | 1s22s22p4 | 2 |
| Chlore | Cl | 1s22s22p63s23p5 | 1 |
L’atome d’Azote possède 5 électrons de valence (2 + 3). Pour respecter la règle de l’octet (8 électrons), il doit donc réaliser 3 liaisons chimiques, qui vont chacune lui permettre de gagner un électron.
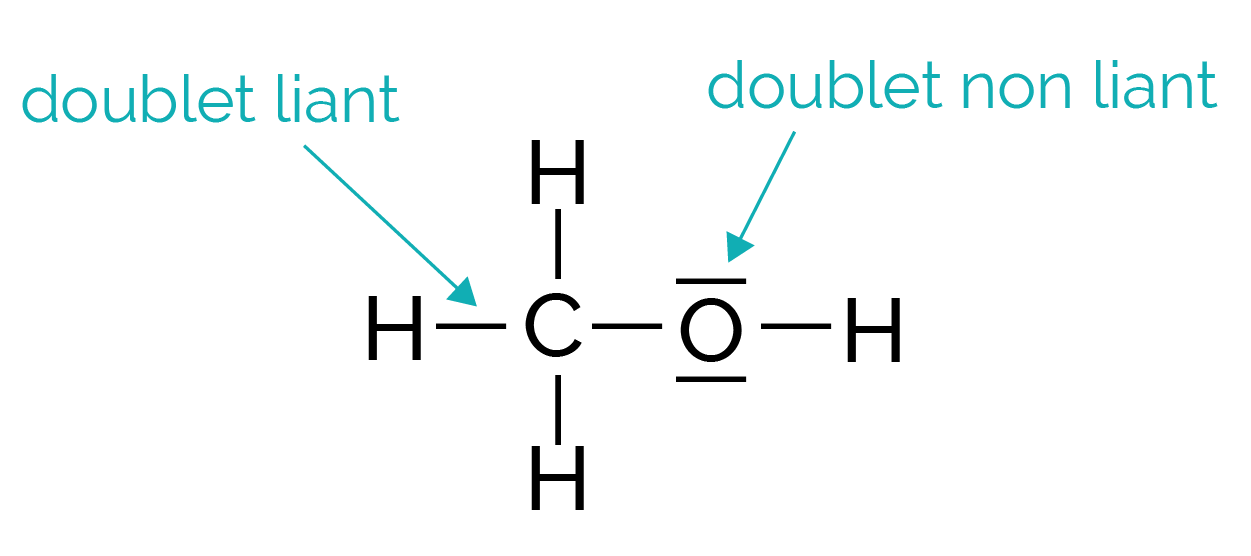
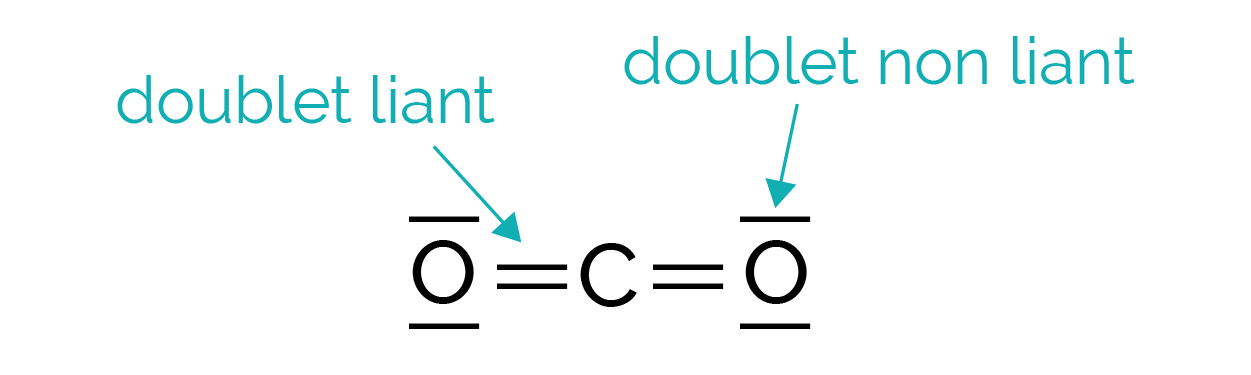
Dans une molécule, les atomes possèdent sur leur couche électronique de valence deux types de doublets électroniques (paquet de deux électrons).
- Les doublets liants constituent les liaisons chimiques réalisées avec d’autres atomes.
- Les doublets non liants appartiennent uniquement à l’atome.
Le tableau suivant indique le nombre de doublets liants et non liants que chaque atome doit réaliser pour respecter la règle du duet ou de l’octet.
| Atome | Symbole |
Nombre de doublets liants |
Nombre de doublets non liants |
| Hydrogène | H | 1 | 0 |
| Carbone | C | 4 | 0 |
| Azote | N | 3 | 1 |
| Oxygène | O | 2 | 2 |
| Chlore | Cl | 1 | 3 |
D’après le tableau de la partie II.A., l’atome d’azote possède 5 électrons de valence et doit réaliser 3 liaisons chimiques. Il partage donc trois de ses électrons avec d’autres atomes pour constituer 3 doublets liants.
Il lui reste donc 2 électrons sur sa couche de valence qui sont non partagés : il constituent un doublet non liant.
L’atome doit soit posséder un seul doublet liant afin d’avoir la structure électronique stable en duet soit posséder quatre doublets liants ou non liants au total afin d’avoir la structure électronique stable en octet.
- Le noyau et les couches électroniques internes sont représentés par le symbole de l’élément.
- Les électrons de la couche externe sont représentés par un point (•) s’ils sont célibataires ou par un tiret (–) s’ils forment un doublet non liant.
Le nombre d’électrons célibataires est égal au nombre de liaisons que doit réaliser l’atome avec d’autres atomes (doublet liant) afin d’avoir une configuration électronique de valence en duet ou en octet.
| Atome | Nombre d’électrons célibataires | Nombre de doublets non liants | Schéma de Lewis |
| Hydrogène | 1 | 0 |
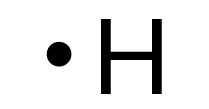
|
| Carbone | 4 | 0 |
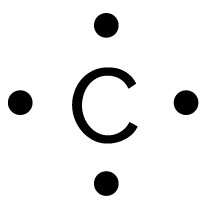
|
| Azote | 3 | 1 |

|
| Oxygène | 2 | 2 |
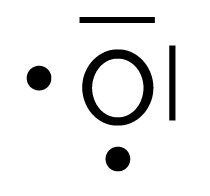
|
| Chlore | 1 | 3 |
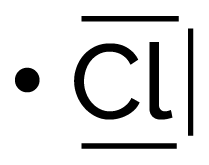
|
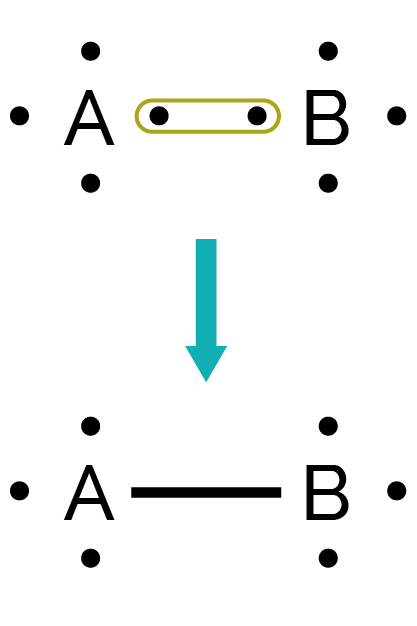
Les atomes s’associent dans une molécule par une liaison simple, en mettant chacun en commun un électron célibataire.
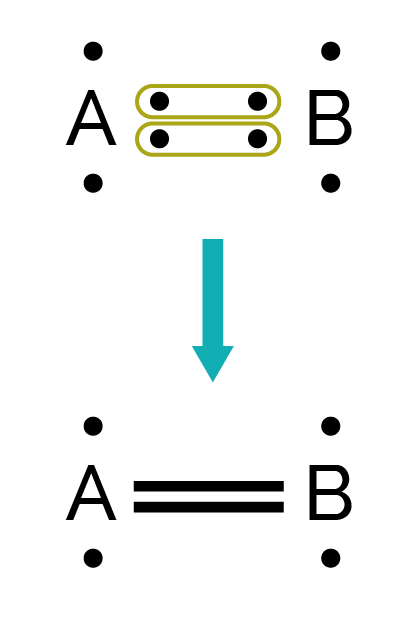
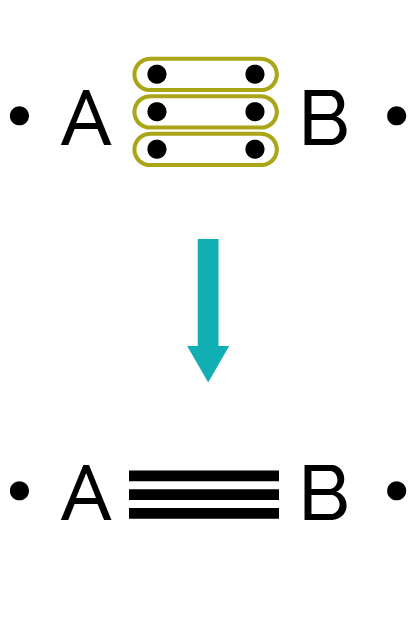
Pour des liaisons multiples, ils mettent en commun deux (liaison double) ou trois (liaison triple) électrons célibataires.
| Liaison simple | Liaison double | Liaison triple |
|
|
|
Représentation de la molécule de méthanol CH4O.
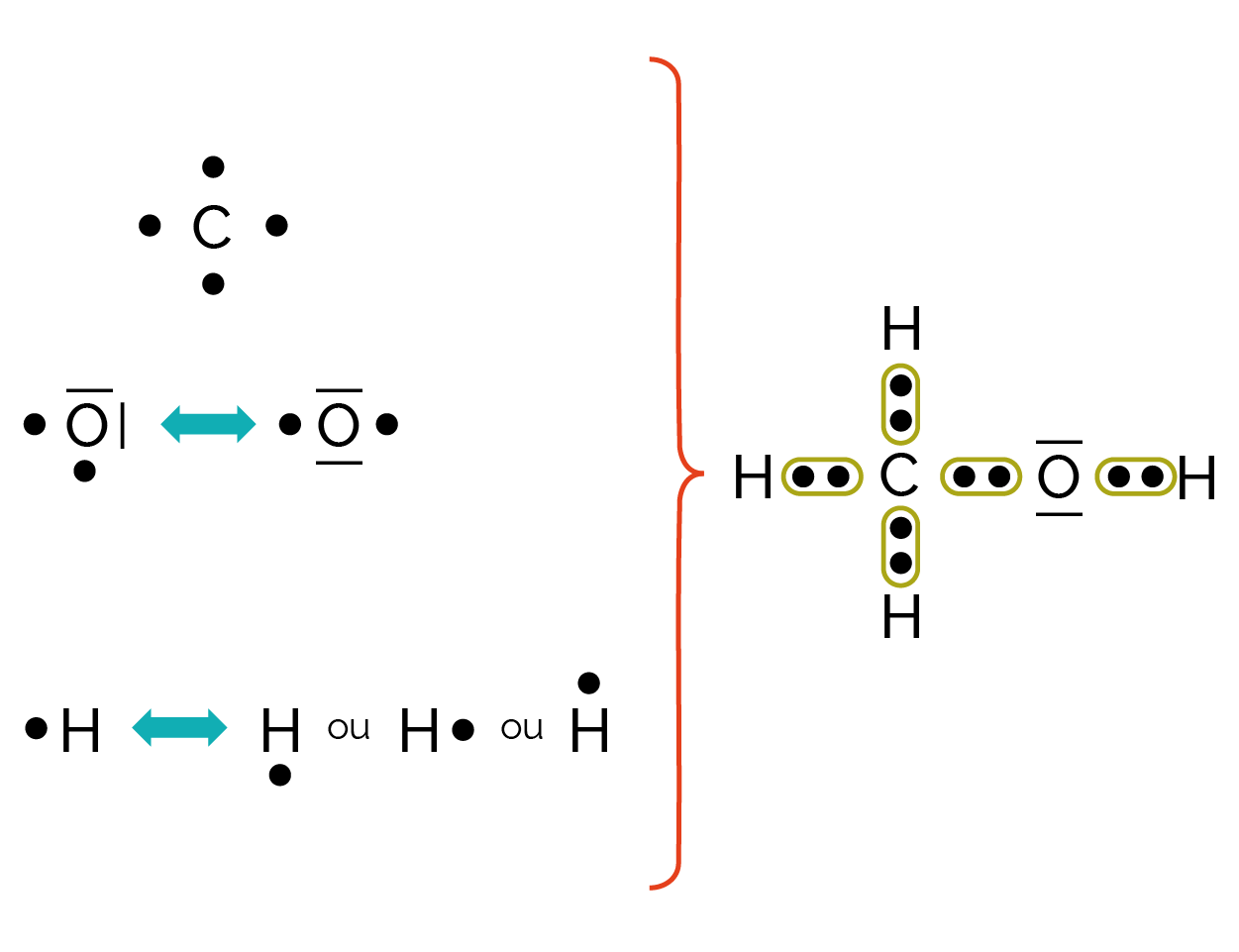

Un atome peut réaliser une liaison simple (représentée par un tiret), double (représentée par deux tirets) ou triple (représentée par trois tirets) avec un autre atome.
On obtient la géométrie d’une entité à partir de son schéma de Lewis.
Les doublets d’électrons de la couche de valence s’écartent en effet au maximum les uns des autres pour former des figures géométriques simples.
Nous allons voir des exemples de géométries de quelques molécules.
| Molécule |
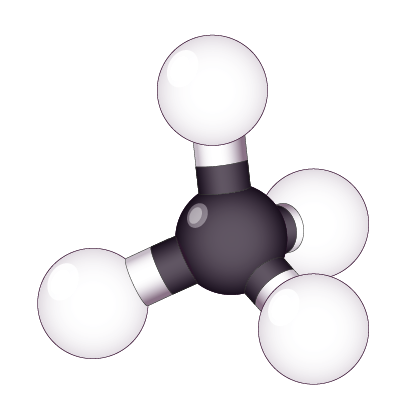
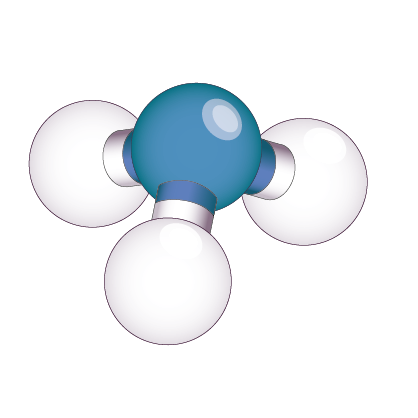
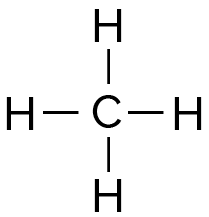
Méthane CH4 |
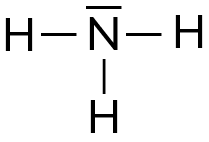
Ammoniac NH3 |
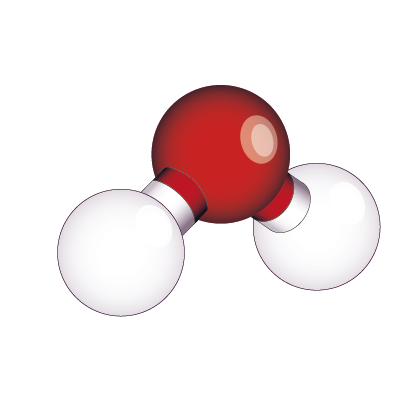
Eau H2O |
| Nombre d’atomes liés à l’atome central | 4 | 3 | 2 |
| Nombre de doublets non liants | 0 | 1 | 2 |
| Géométrie de la molécule | Tétraédrique | Triangulaire | Coudée |
| Représentation de la molécule |
|
|
|
| Schéma de Lewis |
|
|
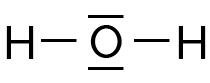
|
Une molécule peut ainsi avoir une géométrie linéaire, coudée, triangulaire, ou tétraédrique.
- Molécule linéaire : un atome central est lié à deux atomes, les trois atomes étant alignés.
- Molécule coudée : un atome central est lié à deux atomes, les trois atomes formant un coude.
- Molécule pyramidale : un atome
central est lié à trois atomes.
L’atome central est au sommet d’une pyramide et les trois autres atomes sont aux sommets de la base triangulaire. - Molécule
tétraédrique : un atome central
est lié à quatre atomes.
L’atome central est au centre d’un tétraèdre et les quatre autres atomes sont aux sommets du tétraèdre.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








