Déterminer la polarité d'une molécule
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Déterminer le caractère polaire ou apolaire d’une entité moléculaire à partir de sa géométrie et de la polarité de ses liaisons.
- Une molécule est polaire si elle possède des liaisons polarisées et si les positions moyennes des charges électriques partielles positives et négatives ne sont pas confondues.
- Si l’une des deux conditions n’est pas réalisée, la molécule est apolaire.
- Les molécules organiques qui contiennent uniquement du carbone et de l’hydrogène sont apolaires car les liaisons C—H sont peu polarisées.
- La molécule
- La polarisation d’une liaison chimique
- L’électronégativité
Une molécule simple est une molécule composée de quelques atomes, entre deux et cinq atomes.
Le dioxygène O2, l’eau H2O, l’ammoniac NH3 ou le méthane CH4 sont des molécules simples.
- Elle possède des liaisons polarisées.
- Les positions moyennes des charges partielles positives et négatives ne sont pas confondues.
La molécule d’eau H2O
possède deux liaisons
polarisées O—H à cause de
la différence
d’électronégativité entre
l’oxygène (![]() (O) = 3,4)
et l’hydrogène (
(O) = 3,4)
et l’hydrogène (![]() (H) = 2,2).
(H) = 2,2).
L’oxygène est plus
électronégatif que
l’hydrogène, il se crée donc
une charge partielle négative ![]() sur l’atome d’oxygène et
une charge partielle positive
sur l’atome d’oxygène et
une charge partielle positive ![]() sur l’atome d’hydrogène
pour chaque liaison simple.
sur l’atome d’hydrogène
pour chaque liaison simple.
L’atome d’oxygène est engagé
dans deux liaisons simples avec des atomes
d’hydrogène, celui-ci porte donc au final
une charge partielle négative ![]() .
.
La représentation de la molécule est alors la suivante.
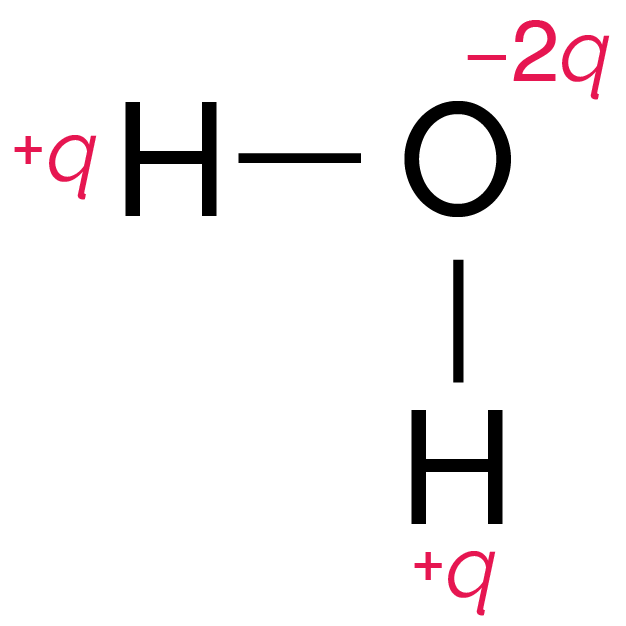
Répartition des charges électriques partielles
dans la molécule d’eau
- La molécule d’eau possède une géométrie coudée.
- Dans la molécule, on fait la somme des charges partielles pour un atome engagé dans plusieurs liaisons polarisées.
et négatives sont-elles non confondues ?
On peut déterminer les positions moyennes G+ des charges partielles positives et G− des charges partielles négatives.
La position moyenne G+ se trouve au milieu du segment qui lie les centres des deux atomes d’hydrogène, tandis que la position moyenne G− se trouve sur le centre de l’atome d’oxygène.
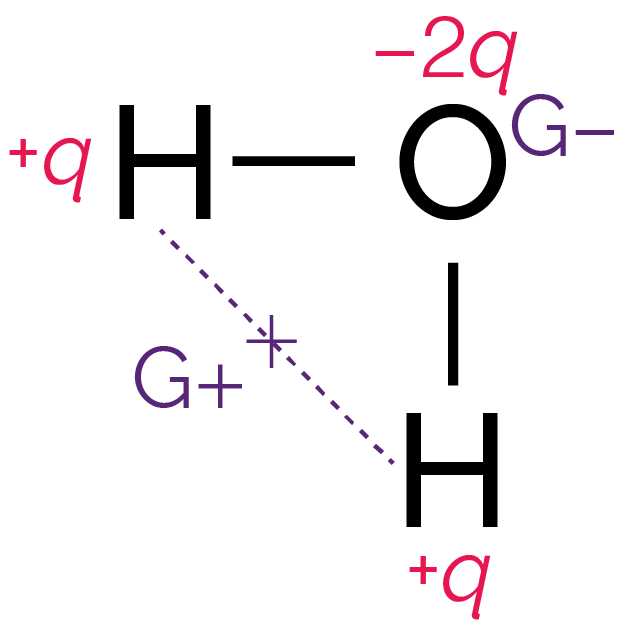
Positions moyennes des charges partielles
positives et négatives
On observe que les deux points G+ et G− ne sont pas confondus.
On constate donc que les deux conditions sont vérifiées : la molécule d’eau est polaire.
La molécule de dioxyde de
carbone CO2 possède deux
liaisons doubles polarisées O=C
à cause de la différence
d’électronégativité entre
l’oxygène (![]() (O) = 3,4) et le carbone (
(O) = 3,4) et le carbone (![]() (C) = 2,6).
(C) = 2,6).
L’oxygène est plus
électronégatif que le carbone, il se
crée donc une charge partielle
négative ![]() sur l’atome d’oxygène et
une charge partielle positive
sur l’atome d’oxygène et
une charge partielle positive ![]() sur l’atome de carbone pour chaque
liaison double.
sur l’atome de carbone pour chaque
liaison double.
L’atome de carbone est engagé dans deux
liaisons doubles avec des atomes
d’oxygène, celui-ci porte donc au final
une charge partielle positive ![]() .
.
La représentation de la molécule est alors la suivante.
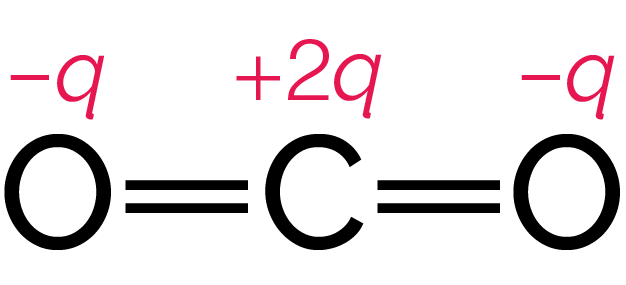
Répartition des charges électriques partielles
dans la molécule de dioxyde de carbone
La molécule de dioxyde de carbone possède une géométrie linéaire.
et négatives sont-elles confondues ?
On peut déterminer les positions moyennes G+ des charges partielles positives et G− des charges partielles négatives.
La position moyenne G− se trouve au milieu du segment liant les centres des deux atomes d’oxygène, tandis que la position moyenne G+ se trouve sur le centre de l’atome de carbone.
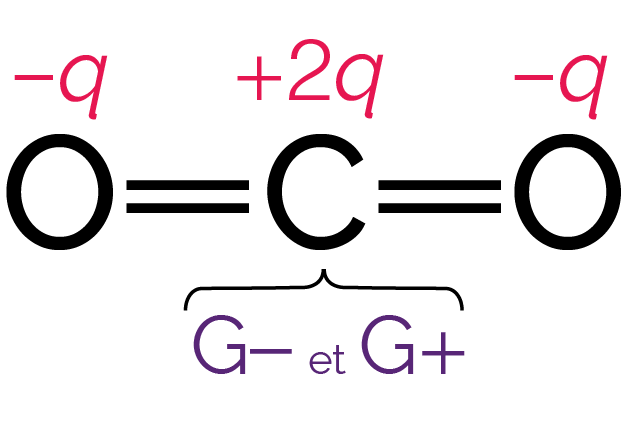
Positions moyennes des charges partielles
positives et négatives
On observe que les deux points G+ et G− sont confondus.
On constate donc qu’une des deux conditions n’est pas vérifiée : la molécule de dioxyde de carbone est apolaire.
Une molécule organique est essentiellement composée d’atomes de carbone et d’hydrogène. Elle peut aussi avoir d’autres atomes tels que l’oxygène ou l’azote.
Les molécules de méthane CH4, de butane C4H10 et d’éthanol C2H6O sont des molécules organiques.
Une molécule organique composée
uniquement d’atomes de carbone (![]() (C) = 2,55)
et d’hydrogène (
(C) = 2,55)
et d’hydrogène (![]() (H) = 2,20) est en conséquence
considérée comme apolaire.
(H) = 2,20) est en conséquence
considérée comme apolaire.
Les molécules de méthane CH4 et de butane C4H10 sont des molécules apolaires.
La présence d’atomes d’azote ou d’oxygène, par exemple, peut être la cause de la polarité d’une molécule organique.
La molécule
d’éthanol C2H6O
possède une liaison
polarisée O—H à cause de
la différence
d’électronégativité entre
l’oxygène (![]() (O) = 3,4)
et l’hydrogène (
(O) = 3,4)
et l’hydrogène (![]() (H) = 2,2) et une autre liaison
polarisée O—C à cause de
la différence
d’électronégativité entre
l’oxygène (
(H) = 2,2) et une autre liaison
polarisée O—C à cause de
la différence
d’électronégativité entre
l’oxygène (![]() (O) = 3,4) et le carbone (
(O) = 3,4) et le carbone (![]() (C) = 2,6).
(C) = 2,6).
L’oxygène est plus
électronégatif que
l’hydrogène et le carbone, il se
crée donc une charge partielle
négative ![]() sur l’atome d’oxygène et
une charge partielle positive
sur l’atome d’oxygène et
une charge partielle positive ![]() sur l’atome d’hydrogène et
sur l’atome de carbone pour chaque liaison
simple.
sur l’atome d’hydrogène et
sur l’atome de carbone pour chaque liaison
simple.
L’atome d’oxygène est engagé
dans deux liaisons simples avec des atomes moins
électronégatifs, celui-ci porte donc au
final une charge partielle
négative ![]() .
.
La représentation de la molécule est alors la suivante.
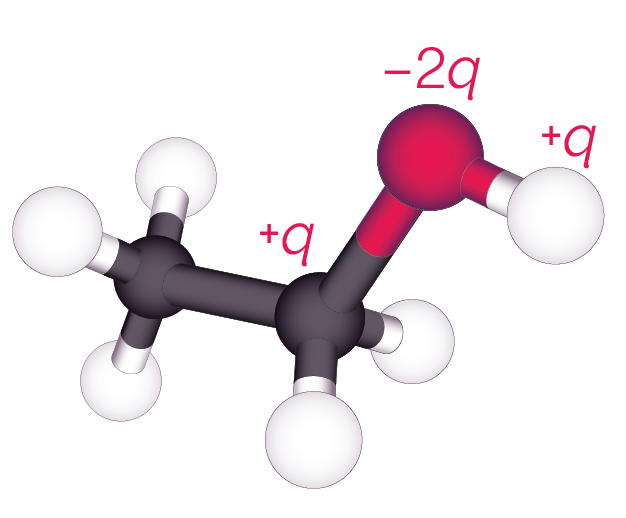
Répartition des charges électriques partielles
dans la molécule d’éthanol
et négatives sont-elles non confondues ?
On peut déterminer les positions moyennes G+ des charges partielles positives et G− des charges partielles négatives.
La position moyenne G+ se trouve sur le segment qui lie les centres des atomes d’hydrogène et de carbone, tandis que la position moyenne G− se trouve sur le centre de l’atome d’oxygène.
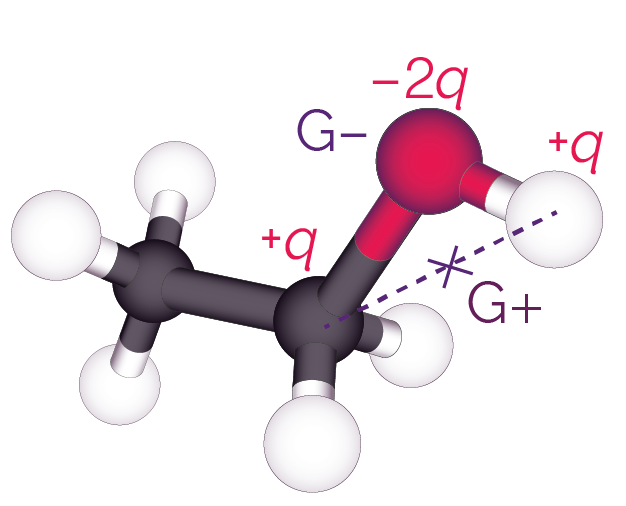
Positions moyennes des charges
partielles positives et négatives
On observe que les deux points G+ et G− ne sont pas confondus.
On constate donc que les deux conditions sont vérifiées : la molécule d’éthanol est polaire.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








