Écrire l'équation associée à une réaction d'oxydoréduction
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Identifier le transfert d’électrons entre deux réactifs et le modéliser par des demi-équations électroniques et par une réaction d’oxydoréduction.
- Établir une équation de la réaction entre un oxydant et un réducteur, les couples oxydant/réducteur étant donnés.
- Un oxydant est une espèce chimique qui capte les électrons.
- Un réducteur est une espèce chimique qui cède des électrons.
- Un couple oxydant/réducteur s’écrit toujours en commençant par l’oxydant.
- Une demi-équation d’oxydoréduction est une oxydation ou une réduction.
- La réaction d’oxydoréduction entre 2 couples met en jeu un échange d’électrons entre l’oxydant qui appartient à un couple et le réducteur qui appartient à l’autre couple.
- Atomes, ions, charge d'un ion ou d'un composé ionique
- Coefficients stoechiométriques et équilibre d’une réaction chimique
Un oxydant est une espèce chimique qui va capter un ou plusieurs électrons.
Il existe 2 types de demi-équation d’oxydoréduction : les oxydations et les réductions.
Le nombre d’électrons permet d'équilibrer les charges entre les deux côtés de l'équation.
- La réaction qui fait intervenir la
transformation du réducteur Ag en
oxydant Ag+ est :
Ag = Ag+ + e–.
- La réaction qui fait intervenir la
transformation du réducteur Cu en
oxydant Cu2+ est :
Cu = Cu2+ + 2e–.
La réaction qui fait intervenir la transformation de l’oxydant Ag+ en réducteur Ag est :
Cette transformation se réalise selon une demi-équation d’oxydoréduction.
On écrit toujours l’oxydant en premier, séparé du réducteur par une barre.
- Le couple d’oxydoréduction de
l’élément cuivre s'écrit
Cu2+ / Cu.
L’oxydant est l’ion Cu2+ et le réducteur qui lui est associé est le métal cuivre Cu. - Couple Fe3+ / Fe2+ :
l'oxydant est l'ion Fe3+ et le
réducteur est
l'ion Fe2+.
L'oxydant et le réducteur du couple appartiennent au même élément, ici l'élément fer.
L'ion hydrogène H+ est l'oxydant et le dihydrogène gazeux H2(g) est le réducteur.
Il faut suivre les étapes suivantes pour écrire la demi-équation associée à ce couple.
- Écrire la demi-équation
(réduction ou oxydation selon ce qui est
demandé, ici on écrit la
réduction) sans équilibrer.
H+(aq) + e– H2(g)
H2(g)
- Équilibrer ensuite les atomes
d’hydrogène.
2H+(aq) + e– H2(g)
H2(g)
- Équilibrer les charges grâce aux
électrons, en neutralisant les 2 charges
positives de H+.
2H+(aq) + 2e– H2(g)
H2(g)
On a pris soin d’équilibrer les atomes et les charges de chaque côté de l’équation.
Il faut aussi préciser l’état physique des réactifs et des produits :
- (s) pour solide ;
- (l) pour liquide ;
- (g) pour gaz ;
- (aq) pour les ions en solutions aqueuses.
L'ion permanganate MnO![]() est l'oxydant et l'ion
manganèse Mn2+ est
le réducteur.
est l'oxydant et l'ion
manganèse Mn2+ est
le réducteur.
Il faut suivre les étapes suivantes pour écrire la demi-équation associée à ce couple.
- Écrire la demi-équation
(réduction ou oxydation selon ce qui est
demandé, ici on écrit la
réduction) sans équilibrer.
MnO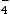 (aq) + e–
(aq) + e–  Mn2+(aq)
Mn2+(aq)
- Pour équilibrer les atomes
d’oxygène, ajouter autant de
molécules d'eau H2O que
nécessaire du côté où
l'élément oxygène est
déficitaire.
MnO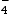 (aq) + e–
(aq) + e–  Mn2+(aq) + 4H2O(l)
Mn2+(aq) + 4H2O(l)
- Si on ajoute des molécules d'eau, il vient
en plus l'élément hydrogène.
Il faut alors équilibrer avec autant d’ions hydrogène H+ que nécessaire du côté où il est absent.
MnO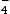 (aq) + 8H+(aq) + e–
(aq) + 8H+(aq) + e–  Mn2+(aq) + 4H2O(l)
Mn2+(aq) + 4H2O(l)
- La demi-équation doit enfin être
équilibrée électriquement.
Il y a ici :
- 7 charges positives « à gauche » sans compter les électrons ;
- et 2 charges positives « à droite ».
 5) « à
gauche ».
5) « à
gauche ».
On obtient alors la demi-équation recherchée.
MnO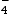 (aq) + 8H+(aq) + 5e–
(aq) + 8H+(aq) + 5e–  Mn2+(aq) + 4H2O(l)
Mn2+(aq) + 4H2O(l)
Lors d’une réaction chimique, il y a conservation :
- de la matière, c'est-à-dire qu’il y a conservation de la nature et du nombre des atomes mis en jeu ;
- des charges.
Pour respecter ces conservations, on utilise des coefficients stœchiométriques devant les éléments qui permettent d’ajuster le nombre des atomes et des charges.
Une réaction chimique est symbolisée par son équation chimique, laquelle dresse le bilan de la réaction.
Après réaction, on retrouve les mêmes atomes qui étaient présents avant la réaction mais qui ont été « agencés » différemment pour former d’autres molécules.
Un oxydant réagit forcément avec un
réducteur et inversement.
Deux oxydants ne peuvent pas réagir entre eux,
de même que deux réducteurs ne peuvent pas
réagir entre eux.
On considère la réaction entre le
métal aluminium Al(s) avec les ions
cuivre Cu2+(aq) : ce sont
les 2 réactifs de cette
réaction.
Il faut suivre les étapes suivantes pour
écrire l’équation associée
à une réaction
d’oxydoréduction.
-
Écrire les 2 couples mis en
jeu.
Cu2+(aq) / Cu(s) et Al3+(aq) / Al(s) -
Écrire les demi-équations
d’oxydoréduction des
2 couples.
On débute par l’élément du couple qui réagit en tant que réactif
(ici Cu2+ et Al sont les réactifs).- demi-équation du couple 1 :
Cu2+(aq) + 2e–
 Cu(s)
Cu(s)
- demi-équation du couple 2 :
Al(s)
 Al3+(aq) + 3e–
Al3+(aq) + 3e–
- demi-équation du couple 1 :
Cu2+(aq) + 2e–
-
Obtenir le même nombre
d’électrons dans chaque
demi-équation.
Faire en sorte d’obtenir le même nombre d’électrons dans chaque demi-équation, afin que les électrons s’éliminent de l’équation finale quand on les additionne.
On multiplie ici la première équation par 3 et la seconde par 2.- demi-équation du couple 1 :
3Cu2+(aq) + 6e–
 3Cu(s)
3Cu(s)
- demi-équation du couple 2 :
2Al(s)
 2Al3+(aq) + 6e–
2Al3+(aq) + 6e–
- demi-équation du couple 1 :
3Cu2+(aq) + 6e–
-
Additionner les deux équations.
Lorsqu’il y a le même nombre d’électrons dans les 2 équations, on additionne les deux équations : on fait la somme de tout ce qui se trouve à gauche du signe « = » puis on fait la somme de tout ce qui se trouve à droite du signe « = » dans les 2 équations.
3Cu2+(aq) + 6e– + 2Al(s) 3Cu(s) + 2Al3+(aq) + 6e–
3Cu(s) + 2Al3+(aq) + 6e–
-
Simplifier l’équation
obtenue.
On simplifie l’équation obtenue en éliminant ce que l’on retrouve de part et d’autre de cette équation.
La réaction d’oxydoréduction est donc :
3Cu2+(aq) + 2Al(s) 3Cu(s) + 2Al3+(aq)
3Cu(s) + 2Al3+(aq)

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








