Description d'un gaz
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
• Toutefois, un gaz est constitué d'un très grand nombre de molécules. Quel modèle microscopique permet d'expliquer les données macroscopiques que l'on peut mesurer ?
Il est donc impossible de décrire le comportement individuel de chaque molécule afin de décrire un gaz.
Pour ce faire, on utilise des grandeurs macroscopiques :
• Le volume (V) du gaz peut s'exprimer en litre (L) ou en mètre cube (m3), avec 1 m3 = 1 000 L.
• La pression (P) du gaz se mesure avec un manomètre. La pression s'exprime en Pascal (Pa).
• La température du gaz se mesure avec un thermomètre. Cette température s'exprime en degré Celsius (°C) ou en Kelvin (K), avec la relation suivante :
20 °C = 20 + 273 = 293 K.
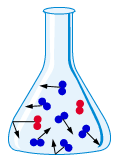
• un gaz (ou un mélange de gaz) est constitué de molécules éloignées les unes des autres, en mouvement permanent. Une molécule se déplace à grande vitesse.
La bouteille de gaz contient de l'air, composé d'environ 80 % de diazote et 20 % de dioxygène.

|
Ces molécules sont en mouvement
perpétuel. Leur mouvement est rectiligne en l'absence d'obstacle. Des chocs peuvent se produire soit avec d'autres molécules soit avec les parois du récipient. Leur trajectoire est alors modifiée. |
|
• Ces mouvements correspondent à l'agitation moléculaire. Elle a lieu dans toutes les directions. Le gaz occupe tout l'espace qui lui est offert : un gaz est expansif.
La vitesse moyenne des molécules de dioxygène et de diazote dans l'air est de 500 m·s-1 environ.
Dans les conditions usuelles, le nombre de chocs subis par une molécule d'un gaz et pendant une seconde est de l'ordre de 108 à 109.
• Un gaz peut être comprimé, ce qui réduit le volume qu'il occupe : un gaz est compressible.
• Lorsqu'on met deux gaz en contact, ils se mélangent.
Étant donné que 1,5 L d'air contient environ 1022 molécules, on décrit un gaz à l'aide de données macroscopiques comme la pression P, le volume V et la température de ce gaz.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








