Un niveau d'organisation : les éléments chimiques
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Produire et analyser différentes représentations graphiques de l’abondance des éléments chimiques (proportions) dans l’Univers, la Terre, les êtres vivants.
- L’équation d’une réaction nucléaire stellaire étant fournie, reconnaitre si celle-ci relève d’une fusion ou d’une fission.
- Calculer le nombre de noyaux restants au bout de n demi-vies et estimer la durée nécessaire pour obtenir une certaine proportion de noyaux restants.
- Utiliser une représentation graphique pour déterminer une demi-vie.
- Utiliser une décroissance radioactive pour une datation (exemple du carbone 14).
- Les noyaux des atomes de la centaine d’éléments chimiques stables résultent de réactions nucléaires qui se produisent au sein des étoiles à partir de l’hydrogène initial.
- La matière connue de l’Univers est formée principalement d’hydrogène et d’hélium alors que la Terre est surtout constituée d’oxygène, d’hydrogène, de fer, de silicium, de magnésium et les êtres vivants de carbone, hydrogène, oxygène et azote.
- Au cours d’une réaction nucléaire de fusion, deux noyaux se réunissent pour former un noyau plus lourd.
- Au cours d’une réaction de fission nucléaire, sous l’impact d’une particule, un noyau se scinde en deux noyaux plus légers.
- Certains noyaux sont instables et se désintègrent (radioactivité). L’instant de désintégration d’un noyau radioactif individuel est aléatoire.
- La demi-vie d’un noyau radioactif est la durée nécessaire pour que la moitié des noyaux initialement présents dans un échantillon macroscopique se soit désintégrée. Cette demi-vie est caractéristique du noyau radioactif.
- Écrire l’équation d’une réaction nucléaire.
- Identifier des isotopes.
Les éléments chimiques sont caractérisés par leur numéro atomique Z qui représente le nombre de protons dans le noyau d’atome. On dénombre 94 éléments chimiques sur Terre qui sont à l’état naturel. Comment ont été formés ces éléments naturels et quelle est leur répartition dans l’Univers ?
Le Big Bang est un modèle cosmologique qui décrit la formation et l’évolution de l’Univers, depuis 13,7 milliards d’années environ jusqu’à aujourd’hui. Il permet de décrire la formation des éléments chimiques que nous connaissons.
L’hydrogène (Z = 1) est le premier élément à avoir été formé, quelques secondes après le Big Bang. Sont venus ensuite l’hélium (Z = 2) et le lithium (Z = 3). Cette formation a été possible grâce aux très hautes températures (de l’ordre d’un milliard de degrés Celsius) et très hautes densités qui régnaient dans cette soupe primordiale du début de l’Univers.
Au bout de 300 secondes, la température et la densité sont devenues trop faibles pour que la formation des éléments chimiques puisse se poursuivre. La nucléosynthèse primordiale s’est achevée ainsi.
Cent millions d’années plus tard, les premières étoiles se sont formées. Dans leur cœur, les conditions de température et de densité sont devenues de nouveau favorables à la formation de nouveaux éléments chimiques. Des éléments plus lourds se sont formés : il s’agit des éléments allant du béryllium (Z = 4) jusqu’au fer (Z = 26). On parle de nucléosynthèse stellaire.
Lorsqu’une étoile est très massive (masse supérieure à 8 masses solaires), elle finit son cycle de vie en s’effondrant sur elle-même et en expulsant les couches externes de sa matière. Il s’agit d’une explosion cataclysmique appelée supernova. Elle a lieu régulièrement dans l’univers, et ce depuis des millions d’années. Lors de cette explosion, les éléments plus lourds que le fer se forment, jusqu’au plutonium (Z = 94) et se sont dispersés dans l’espace environnant. Il s’agit de la nucléosynthèse explosive.
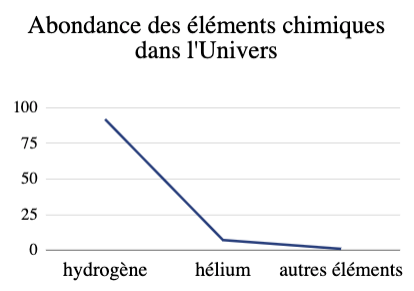
L’abondance est très variable en fonction du système étudié. Par exemple, le système « Univers » est principalement composé d’hydrogène et d’hélium.
| Éléments | Hydrogène | Hélium | Autres |
| Abondance (%) | 92,0 | 7,1 | 0,9 |
Le système « Terre » est, quant à lui, principalement composé d’oxygène, de silicium, d’aluminium, de fer et de calcium.
| Éléments | Oxygène | Silicium | Aluminium | Fer | Calcium |
| Abondance (%) | 49,1 | 25,5 | 7,5 | 4,6 | 3,3 |
Les autres éléments ne sont pas en proportion négligeable :
| Éléments | Sodium | Potassium | Magnésium | Hydrogène |
| Abondance (%) | 2,6 | 2,4 | 2,0 | 0,9 |
Un être vivant est principalement composé de carbone, d’oxygène, d’hydrogène et d’azote.
| Éléments | Oxygène | Carbone | Hydrogène | Azote |
| Abondance (%) | 65,4 | 18,1 | 10,1 | 3,0 |
Il existe différents types de graphiques pour représenter les abondances :
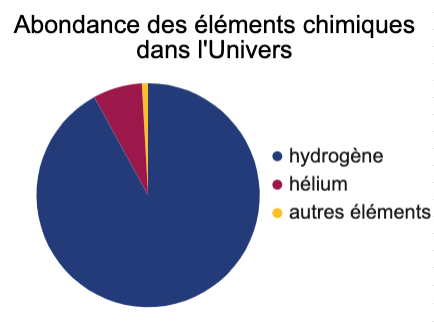 Diagramme circulaire |
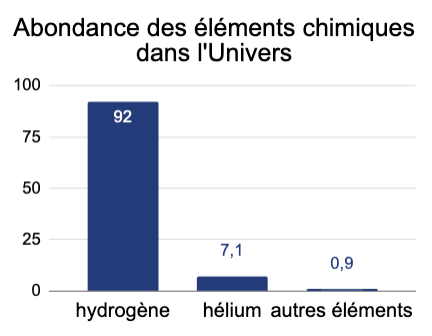 Diagramme en bâtons |
 Courbe |
Dans le cœur des étoiles, des réactions nucléaires, c’est-à-dire impliquant des noyaux atomiques, ont lieu. Elles permettent la formation de nouveaux éléments chimiques. On distingue deux types de réactions nucléaires : la fusion et la fission.
- les protons qui portent une charge électrique élémentaire positive ;
- les neutrons qui sont électriquement neutres, c’est-à-dire que la charge électrique portée est égale à zéro.
Le noyau d’un atome X est caractérisé par deux nombres :
- le nombre de masse A qui est égal au nombre de nucléons dans le noyau (protons et neutrons) ;
- le numéro atomique Z qui est égal au nombre de protons dans le noyau.
Le noyau est symbolisé par l’écriture conventionnelle suivante.
 Écriture
conventionnelle du noyau d'un élément
chimique
Écriture
conventionnelle du noyau d'un élément
chimique
Les particules suivantes sont symbolisées de la même manière que le noyau.
| Particule | Proton | Neutron | Électron | Positon |
| Symbole |

|

|

|

|
Le nombre Z, pour les particules, est appelé nombre de charge. On peut aussi utiliser ce nom pour les noyaux atomiques.
Le positon est une particule élémentaire qui correspond à l’antiparticule de l’électron. Il possède les mêmes caractéristiques que celui-ci hormis sa charge qui est opposée. Le positon porte donc une charge électrique positive élémentaire.
Cela signifie donc qu’ils possèdent des numéros atomiques identiques et des nombres de masse différents. Ces deux noyaux appartiennent au même élément chimique.
L’élément hydrogène possède trois isotopes : l’hydrogène 1 (le plus abondant), l’hydrogène 2 (aussi appelé deutérium) et l’hydrogène 3 (aussi appelé tritium).
Cette réaction nécessite de très hautes températures et de fortes pressions, conditions qui sont remplies dans le cœur des étoiles. Il s’agit donc d’une réaction nucléaire provoquée.
La réaction de fusion est modélisée par une équation de réaction nucléaire. L’une des premières réactions de fusion nucléaire qui a lieu dans le cœur d’une étoile est la suivante :
Le noyau d’hydrogène 2 formé est plus lourd que celui des noyaux d’hydrogène 1, qui ont fusionné. Pour le vérifier, il suffit de comparer leurs nombres de masse respectifs : 2 est supérieur à 1.
Il s’est formé au cours de la réaction un positon.
Pendant les réactions de fusion, des particules (proton, neutron, électron…) sont produites en plus du ou des noyaux atomiques. Dans la réaction de fusion précédente, on observe la création d’un positon.
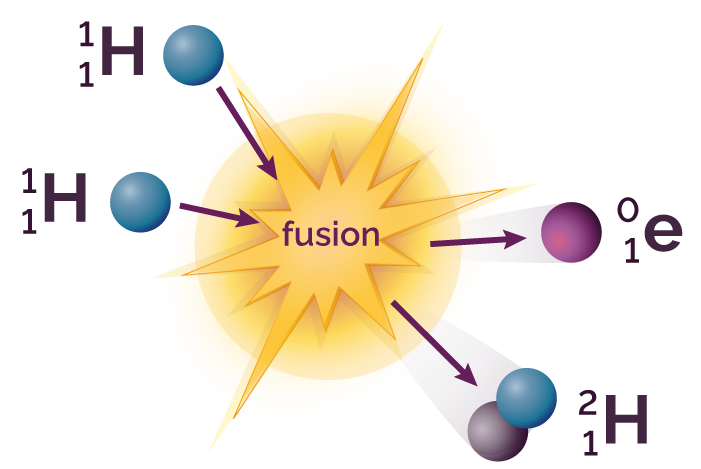
Réaction de fusion entre deux noyaux d’hydrogène 1
Au cours d’une réaction nucléaire, il y a conservation :
- du nombre de masse A ;
- du nombre de charge Z.
Pour la réaction mentionnée précédemment, nous avons les égalités suivantes :
- 1 + 1 = 2 + 0 : la conservation du nombre de masse A est vérifiée.
- 1 + 1 = 1 + 1 : la conservation du nombre de charge Z est vérifiée
Cette réaction nécessite une source de particules capables de fissionner les noyaux lourds. Il s’agit donc d’une réaction nucléaire provoquée.
La réaction de fission est modélisée par une équation de réaction nucléaire :
Le noyau d’uranium 235 est plus lourd que les deux noyaux qui sont formés, le strontium 94 et le xénon 139. Pour le vérifier, il suffit de comparer leurs nombres de masse respectifs : 235 est supérieur à 94 et 139.
Il s’est formé au cours de la réaction trois neutrons.
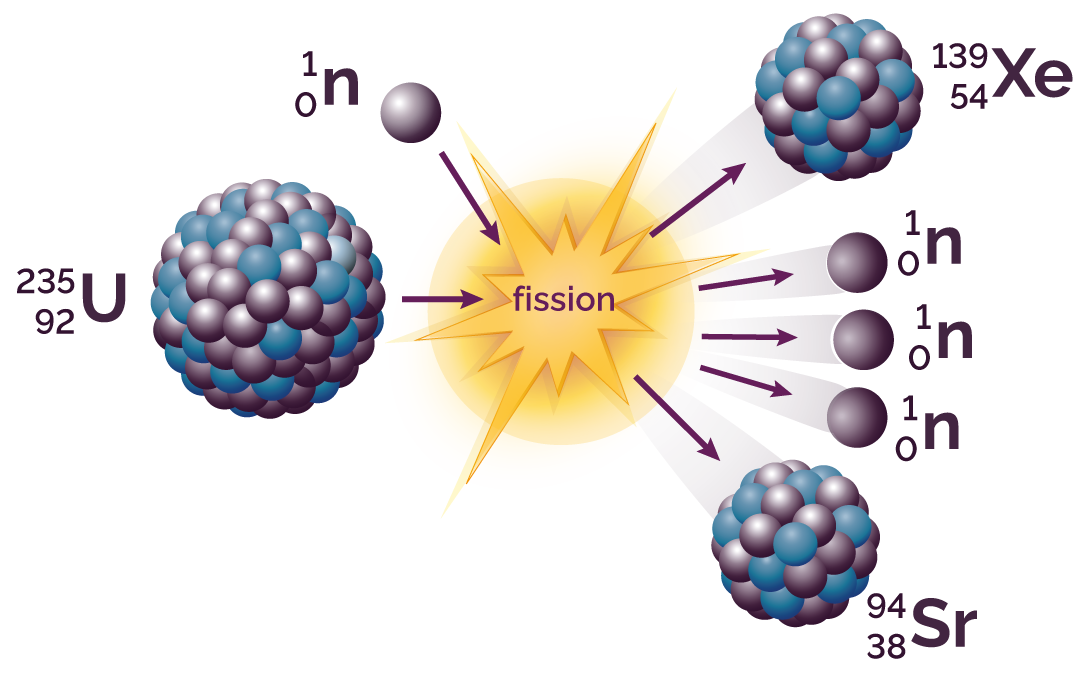
Réaction de fission de l’uranium 235
Pour la réaction mentionnée précédemment, les lois de conservation du nombre de masse A et du nombre de charge Z sont respectées :
- 1 + 235 = 94 + 139 + 3 × 1 : conservation du nombre de masse A.
- 0 + 92 = 38 + 54 + 3 × 0 : conservation du nombre de charge Z.
Parmi les noyaux atomiques, il en existe certains qui sont instables et qui se transforment spontanément en un nouveau noyau : c’est le phénomène de radioactivité.
Cette désintégration s’accompagne de l’émission d’une particule qui peut être un électron, un positon ou une particule α.
- Il existe trois types de radioactivité,
chacune définie par le type de particule
émise :
Type de radioactivité alpha (α) béta moins (β−) béta plus (β+) Particule émise noyau d’hélium 4 électron positon - Le positon est un noyau d’hélium 4.
La radioactivité est un phénomène :
- aléatoire : la désintégration peut avoir lieu à n’importe quel instant ;
- spontané : la désintégration s’effectue sans influence extérieure sur le noyau ;
- inéluctable : à un moment ou un autre, le noyau radioactif va forcément se désintégrer ;
- indépendant de la composition du milieu.
La réaction de désintégration radioactive est modélisée par une équation de réaction nucléaire :
![]()
Le noyau de polonium 218 (Z = 84) se transforme en un noyau de plomb 214 (Z = 82) qui n’appartient pas au même élément chimique (84 ≠ 82).
Un noyau d’hélium 4 est émis au cours de la réaction.
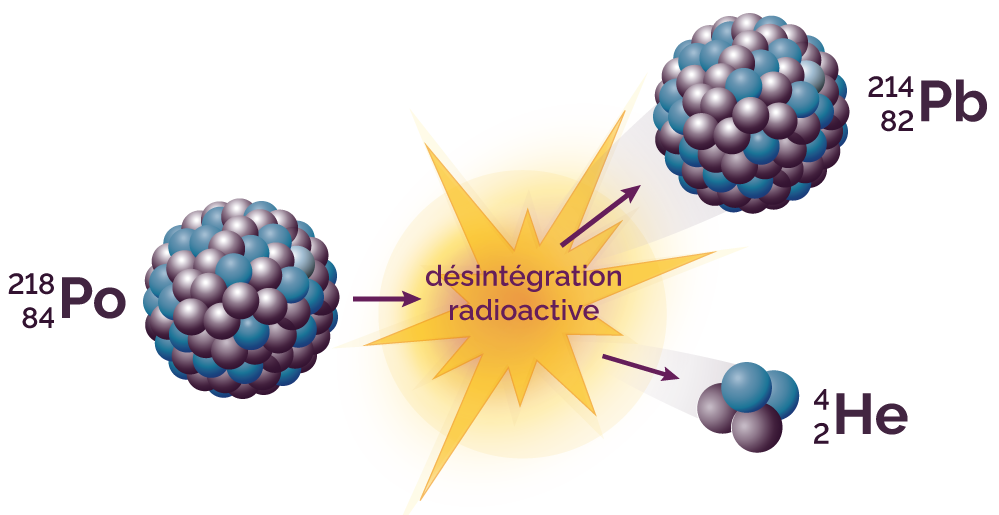
Réaction de désintégration radioactive du polonium 218
Pour la réaction mentionnée précédemment, les lois de conservation du nombre de masse A et du nombre de charge Z sont respectées :
- 218 = 214 + 4 : conservation du nombre de masse A.
- 84 = 82 + 2 : conservation du nombre de charge Z.
Considérons un échantillon de matière contenant un nombre de noyaux radioactifs égal à N0 à un instant initial (t = 0 s).
Au cours du temps t, ce nombre va diminuer du fait de la désintégration radioactive. Le nombre N(t) de noyaux radioactifs encore présents à un instant t est une fonction décroissante du temps.
L’évolution temporelle de ce nombre peut être modélisée par la loi de décroissance radioactive dont la représentation graphique est la suivante.
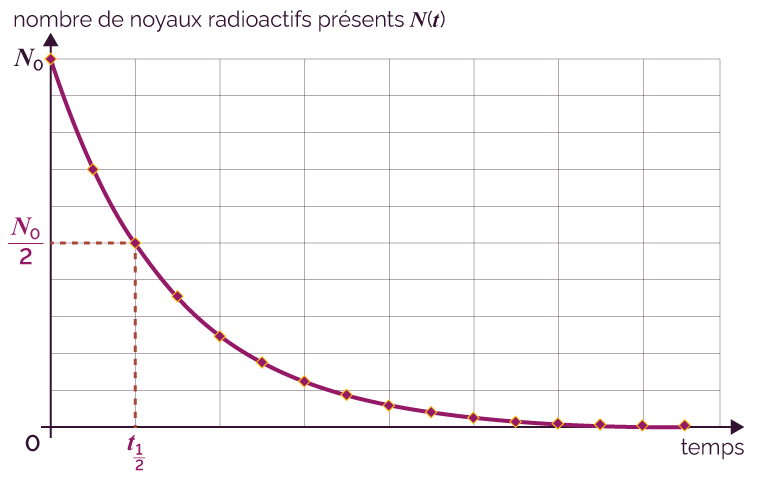 Allure d'une courbe de
décroissance radioactive
Allure d'une courbe de
décroissance radioactive(pour un échantillon de matière quelconque)
La valeur de la demi-vie est caractéristique du noyau radioactif et peut prendre des valeurs très différentes d’un noyau à l’autre.
| Noyau radioactif | Béryllium 8 | Iode 131 | Hydrogène 3 | Uranium 235 |
| Demi-vie | 6,7 × 10−17 s | 8,02 jours | 12,3 ans | 7,04 × 108 ans |
À chaque fois qu’une durée égale à la demi-vie s’écoule, le nombre de noyaux présents dans l’échantillon est divisé par deux.
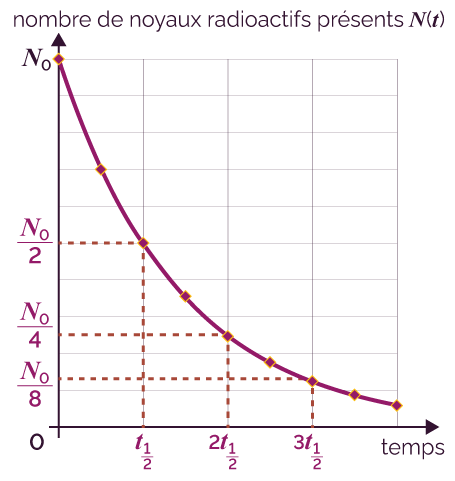
Allure d'une courbe de décroissance radioactive
et principe de la demi-vie
Pour calculer le nombre de noyaux restants grâce à la formule, il faut connaitre les puissances de deux.
21 = 2 ; 22 = 4 ; 23 = 8 ; 24 = 16 ; 25 = 32 ; 26 = 64
L’isotope du carbone le plus abondant sur Terre est le carbone 12, tandis que le carbone 14 est un isotope radioactif dont la demi-vie est égale à 5734 ans.
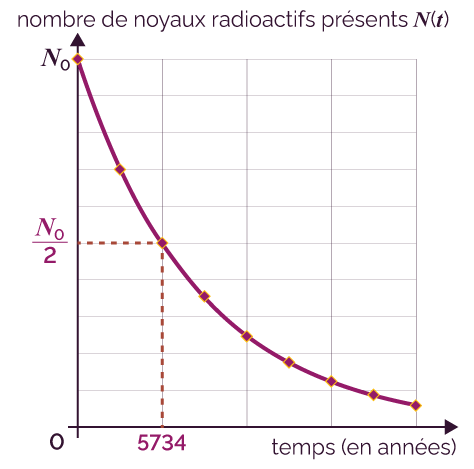
Courbe de décroissance radioactive du carbone 14
Le carbone 14 est formé dans la haute atmosphère et se combine rapidement avec l’élément oxygène pour former du dioxyde de carbone CO2.
Les organismes vivants (animal ou végétal) échangent en permanence du dioxyde de carbone avec leur environnement par la respiration ou l’alimentation. Ils ingèrent donc du carbone 14 dont la teneur dans les tissus vivants reste la même durant toute leur vie, égale à celle de l’atmosphère.
Après la mort de l’organisme, les échanges avec l’extérieur s’arrêtent et le carbone 14 n’est plus renouvelé. La teneur en carbone 14 diminue donc à partir de ce moment-là.
La teneur initiale en carbone 14 est égale au même rapport, lorsque l’organisme était vivant.
Pour un échantillon de matière donné, on peut déterminer l’évolution de sa teneur en carbone 14 au cours du temps, puis tracer l’évolution du rapport de cette teneur sur la teneur initiale.
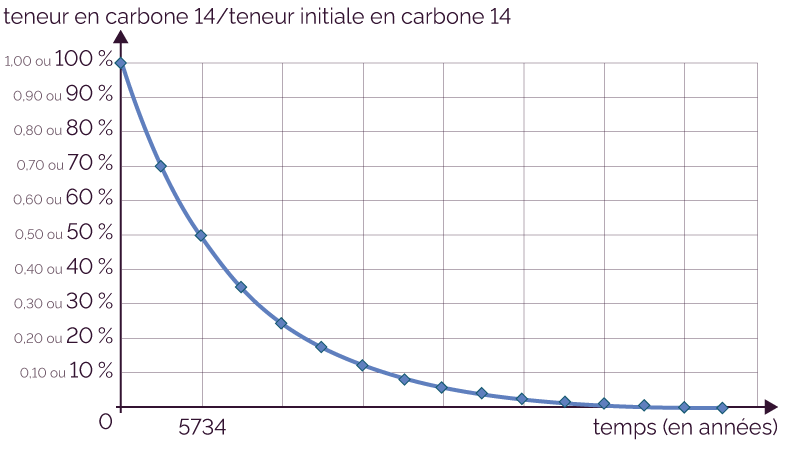
Courbe du rapport entre la teneur en carbone 14
et la teneur en carbone 14 initiale
Connaitre la teneur actuelle en carbone 14 d’un objet fabriqué à partir d’un organisme vivant permet de déterminer la date de la mort de l’organisme.
Si l’on suppose que la fabrication de l’objet est survenue juste après la mort de l’organisme, cette teneur en carbone 14 permet de dater la fabrication de l’objet. Par exemple, un objet fabriqué avec le bois d’un arbre abattu peut être daté. Cette technique est très utile en archéologie pour dater des objets jusqu’à 50 000 ans.
Si l’on détermine pour un objet que le rapport entre la teneur en carbone 14 et celle initiale est égale à 70 % en exploitant la courbe ci-dessus, cela signifie qu’il s’est écoulé environ

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !









