Séparation et identification des espèces chimiques
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Plusieurs techniques d'identification sont à sa disposition. Lesquelles ?
• Principe : Le mélange à analyser est déposé sur une phase fixe (une place de silice par exemple).
Le bas de cette plaque trempe dans une phase liquide, appelée éluant (mélange de solvants). Lors de la montée de l'éluant par capillarité (phénomène d'élution), la phase dite mobile entraîne les différentes espèces chimiques contenues dans le mélange à des vitesses différentes. Les espèces se séparent donc et forment des tâches, chaque tâche correspondant à une espèce chimique différente.
• Application à l'identification : Des espèces chimiques identiques migrent à des hauteurs identiques sur une même plaque. Il suffit donc de déposer à côté du mélange à analyser, une ou plusieurs espèces chimiques, dites de référence, que l'on supposer être présentes dans le mélange et dont on connaît les caractéristiques de migration. On peut alors identifier une espèce chimique par comparaison de ces dépôts de migration avec ceux d'une espèce de référence.
• Révélation du chromatogramme : La révélation permet de faire apparaître sur la plaque les dépôts, incolores avant révélation ; l'ensemble (plaque et dépôts révélés) s'appelle un chromatogramme.
Il existe plusieurs techniques de révélation :
– révélation aux vapeurs de diiode ;
– révélation au permanganate ;
– révélation aux UV.
Exemple : Sur une plaque de silice ont été déposées 3 solutions A, B et C. Après révélation, on obtient le chromatogramme ci-dessous. Quelles informations nous donne ce chromatogramme ?
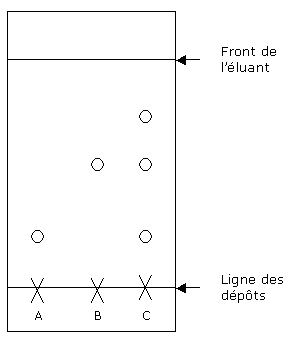
La solution B est constituée d'une seule espèce chimique, différente de celle contenue dans A.
La solution C est constituée de 3 espèces chimiques. Parmi ces trois espèces se trouvent celle présente dans A et celle présente dans B.
• Sa température d'ébullition : Téb
C'est la température sous laquelle se font les changements d'état et liquéfaction :
• Sa température de fusion : Tf
C'est la température sous laquelle se font les changements d'état fusion et solidification :
Exemple : Pour l'eau on a Tf = 0 °C (à la pression atmosphérique).
Remarque : Les valeurs données dans les tables sont mesurées sous pression atmosphérique normale et pour des espèces chimiques pures.
• Sa masse volumique : μ
C'est la masse qu'occupe 1 m3 de l'espèce chimique étudiée. Soit m la masse qu'occupe un volume V.
Exemple : Pour l'eau on a μeau = 1 000 kg.m-3 = 1 kg.L-1
• Sa densité : d
C'est le rapport de la masse volumique de l'espèce sur la masse volumique de l'eau pour les liquides et les solides.
• Son indice de réfraction n par rapport à l'air :
Lorsqu'un rayon lumineux passe de l'air à un milieu transparent constitué d'une espèce chimique, il est dévié.
Ce milieu est caractérisé par un indice de réfraction n donné grâce à la loi de Descartes :
où i désigne l'angle d'incidence, et r le rayon réfracté.
Cet indice est caractéristique d'un corps pur donné. L'appareil qui permet sa détermination immédiate à partir de ces mesures d'angles est le réfractomètre.
Exemple : L'indice de réfraction de l'eau est neau = 1,33.
• Sa solubilité dans un solvant : s
C'est la masse maximale de l'espèce que l'on peut dissoudre dans 1 litre de solvant ; s s'exprime en g.L-1 (ou en kg.L-1).
Exemple : pour l'acide benzoïque, on peut dissoudre au maximum 2,4 g dans 1 litre d'eau ; sa solubilité dans l'eau est donc s = 2,4 g.L-1.
L'ensemble des caractéristiques physiques d'une espèce chimique permet de l'identifier : elles constituent sa carte d'identité.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








