Sélectivité en chimie organique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Les groupes caractéristiques permettent à la molécule d’avoir certaines propriétés. On parle de fonction organique afin d’évoquer la propriété acquise.
Exemple : un groupe hydroxyle greffé sur un carbone tétragonal donne une fonction alcool. Un groupe carboxyle
Exemple : La molécule ci-dessous est porteuse d’une fonction alcool et acide carboxylique.

Pour nommer une telle molécule, on fera appel au nom courant de la molécule ou plus souvent, à la nomenclature officielle en chimie. Pour cette seconde solution, on remarque alors que le nom de la molécule permet de retrouver lesdites fonctions organiques, au niveau du ou des préfixes, et de la terminaison.
Remarque : Dans l’exemple donné ci-dessous, la fonction acide est au niveau de la terminaison et la fonction alcool est en préfixe, via le hydroxy. On dit que la fonction acide a priorité sur la fonction alcool (également au niveau de la numérotation). Les priorités entre fonctions sont fixées par des règles établies par la nomenclature officielle. Cet aspect n’est pas exigible en Terminale S.
Problématique : L’emploi de molécules polyfonctionnelles en tant que réactifs est très courant en chimie organique, car les espèces chimiques synthétisées sont elles-mêmes des molécules polyfonctionnelles. En effet, cela permet à ces dernières d’avoir les propriétés souhaitées. Exemple : molécules d’aspirine et de paracétamol. Si on « retire » une partie de ces molécules, elles n’auront pas la même efficacité, ou pourraient même avoir des propriétés non désirées.
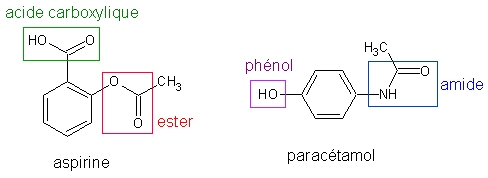
Lors d’une synthèse, on cherche à faire réagir un des groupes fonctionnels de la molécule polyfonctionnelle. La difficulté est que les autres groupes fonctionnels pourraient réagir sans qu'on le veuille, conduisant à une molécule synthétisée différente de celle escomptée. C’est le rôle du chimiste de prévoir cet effet pervers et de l’empêcher, ou du moins le limiter. Pour cela, il dispose de deux méthodes : l’emploi de réactifs chimiosélectifs et la protection de fonctions.
Interprétation : L’explication de ce comportement est explicable en étudiant le mécanisme réactionnel du processus qui a lieu. Plus précisément, il peut y avoir compétition entre les fonctions de la molécule polyfonctionnelle, et au final une peut avoir l’avantage sur les autres. Cela se traduit par une réaction unique, les autres ne se produisant alors pas, car trop défavorisées.
Exemple : Le paracétamol est synthétisé par une réaction totale entre le para-aminophénol et l’anhydride éthanoïque :
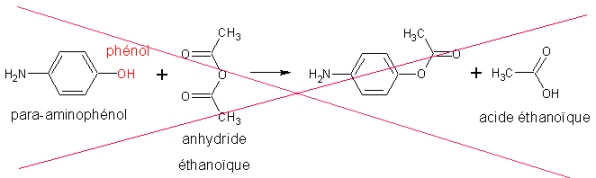
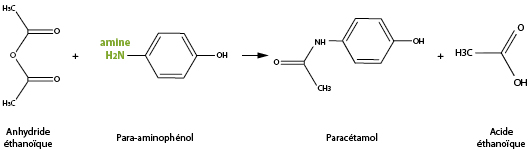
La fonction phénol pourrait réagir avec l’anhydride d’acide, comme il le fait d’ailleurs lors de la synthèse de l’aspirine. Elle ne le fait pas lors de la synthèse du paracétamol, car le N de la fonction amine est meilleur donneur de doublets d’électrons (site nucléophile) que le O de la fonction phénol.
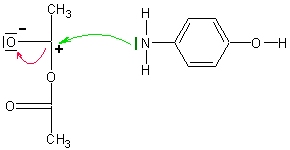
Remarque : Dans la pratique, il n’est pas toujours aisé de deviner si une réaction sera sélective ou pas. De plus, selon les conditions expérimentales, les choses peuvent changer ! En effet, un réactif ordinairement chimiosélectif pour une réaction donnée peut perdre ce comportement s’il est concentré et chauffé, en s’attaquant alors à plusieurs fonctions différentes d’une molécule polyfonctionnelle.
Exemple : la soude agit préférentiellement sur la fonction acide carboxylique de l’aspirine, mais de la soude concentrée et chauffée peut aussi s’attaquer à la fonction ester (hydrolyse basique) de la molécule.
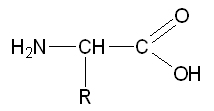
R désignant le reste de la molécule. Deux acides aminés peuvent réagir ensemble selon la réaction,

formant alors le dipeptide
La protection de fonctions : Quand l’emploi de réactifs chimiosélectifs n’est pas possible ou ne suffit pas à sélectionner la réaction que l’on veut faire, il est possible de faire appel à la protection de fonctions. La finalité de la protection est de faire en sorte qu’un groupe fonctionnel ne réagisse pas pendant la réaction. Une fois celle-ci terminée, on peut déprotéger ledit groupe fonctionnel.
Exemple : Pour la synthèse d’un dipeptide, on propose alors le mécanisme suivant :
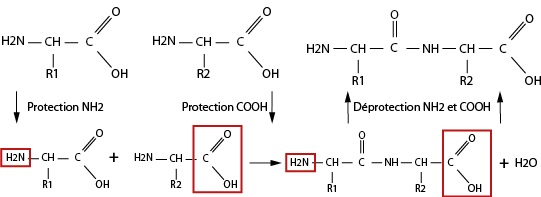
Remarque (non exigible) : dans la pratique, la fonction
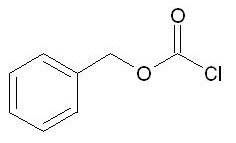
Chloroformiate de benzyle
En milieu basique, celle-ci s’associe avec la fonction
• L’utilisation de réactifs chimiosélectifs, c'est-à-dire ne réagissant qu’avec le groupe fonctionnel cible.
• La protection de fonctions, qui consiste à bloquer un ou des groupes fonctionnels afin qu’ils ne puissent pas réagir, au moins le temps de la réaction de synthèse.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








