La chimie durable
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Mais, si le pétrole fut une ressource abondante et relativement peu chère, ce n’est plus le cas de nos jours. Les ressources fossiles ne sont pas inépuisables, et leur consommation actuelle est largement supérieure au temps requis pour que le pétrole se reforme naturellement (plusieurs millions d’années …).
Il est alors proposé la notion de chimie durable, dont le concept est basé sur celui du développement durable. Plus précisément, l’idée est d’utiliser des ressources naturelles renouvelables. Les biocarburants sont un exemple typique de cette démarche :
Avantages :
• Ressources naturelles pouvant être produites en grandes quantités par l’agriculture.
• Production potentiellement moins polluante : à comparer à l’extraction pétrolière des sables bitumineux hautement polluants, marées noires, etc.
• Produits issus de la chimie durable eux-mêmes moins polluants que les produits pétroliers, contenant du soufre et autres polluants.
• Démarche à long terme, où il n’est plus à craindre la raréfaction du pétrole et des troubles qui en découleraient : hausse des prix, conflits, etc.
• Même si un biocarburant rejette du
Inconvénients :
• Les biocarburants sont accusés d’être une source de concurrence par rapport à la production alimentaire humaine, pouvant accentuer les difficultés des régions où l’accès à la nourriture est difficile.
• Quid de la déforestation qui serait engendrée pour produire de nouvelles terres cultivables ?
• L’agriculture n’est pas sans conséquence pour l’environnement : pesticides, épuisement des sols et des ressources, dont l’eau douce …
• Même si le bilan carbone est meilleur qu’avec le pétrole, il persiste des rejets de
Mis à part l’aspect énergétique, cette transition pétrole / agro-ressources est également possible pour d’autres applications : matières plastiques, solvants, etc. Autrement dit, le pétrole serait remplaçable.
Un des enjeux de la chimie verte est alors de choisir les réactions de synthèse qui minimisent le nombre de réactions et évitent les pertes au maximum. Pour quantifier l’efficacité d’une synthèse par rapport à la limitation des pertes, on considère deux grandeurs : l’économie d’atomes et le facteur E.
→ L’économie d’atomes (ou utilisation atomique) UA est le rapport de la masse molaire du produit recherché par la somme des masses molaires des atomes impliqués dans le ou les réaction(s) :
La valeur obtenue est un pourcentage. Dans ce calcul, chaque masse molaire est pondérée par le coefficient stœchiométrique de l’élément chimique apparaissant dans le ou les réaction(s).
Exemple : allylation du phénol
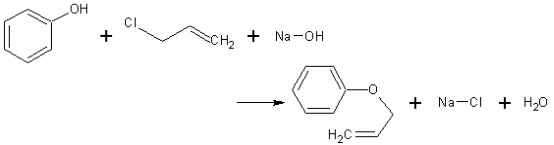
→ Le facteur E est le rapport de la masse de sous-produits formés par la masse du produit recherché. Le nombre obtenu est nul dans le cas d’une « réaction parfaite », ne produisant aucun sous-produit. A l’opposé, le facteur E est supérieur à 1 si l’on obtient une masse de sous-produits plus forte que celle du produit recherché. Pour l’industrie pétrolière (raffinage),
Remarque : le facteur E ne rend pas compte que la dangerosité des sous-produits formés par les réactions. D’autre part, il apporte autant d’information que l’UA, pas plus, pas moins.
Exemple : l’eau supercritique possède des propriétés de solvant intéressantes, notamment pour traiter les déchets. Un fluide est qualifié de supercritique s’il est porté à certaines températures et pression (
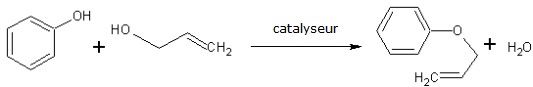
D’autre part, l’utilisation de catalyseurs permet de provoquer les réactions chimiques voulues dans des conditions de température et pression moins exigeantes que sans leur emploi. L’avantage immédiat est l’économie d’énergie, puisqu’il n’est plus besoin de chauffer le système ou de le porter à de hautes pressions.
Dans cet esprit, la chimie douce désigne des synthèses chimiques se déroulant dans des conditions proches des conditions « normales » : température ambiante, pression atmosphérique normale, pH neutre ... Cette notion s’oppose à celle de chimie dite « dure », où des températures et pressions fortes sont atteintes (raffinage du pétrole …). D’ailleurs, en travaillant dans des conditions moins agressives, on limite le risque d’accident industriel : explosion d’une conduite sous pression …
Toutefois, remplacer un processus de chimie industrielle classique par un processus de chimie douce suppose de savoir comment procéder. De nos jours, nous ne savons le faire que pour un nombre très restreint de processus. Les processus qui ont lieu dans la Nature sont souvent une source d’enseignements pour le chimiste.
Exemple : les diatomées sont des organismes unicellulaires. Certaines ont la particularité de synthétiser une carapace de verre (frustule). Actuellement, en laboratoire, les chercheurs savent reproduire les réactions utilisées par les diatomées, dans un procédé nommé « sol-gel », afin de synthétiser divers types de verre.
Limitation des déchets : Via l’économie d’atomes, le choix des solvants, l’optimisation du processus opératoire, on cherche à minimiser la production de déchets et leur toxicité. Diminuer l’impact environnemental est une finalité de cette démarche. D’autre part, en élaborant un produit de consommation avec des matériaux biodégradables, l’impact des déchets engendrés se trouve alors réduit.
Recyclage : Pour certains produits en fin de vie, le recyclage consiste à récupérer les matériaux qui les constituent pour pouvoir les exploiter de nouveaux. Il y a plusieurs avantages à cela :
• Face à l’épuisement des ressources naturelles, le prix de certaines matières premières tendra forcément à augmenter. Cela concerne tout particulièrement les métaux. D’ailleurs, ces derniers sont pleinement recyclables, par leur refonte.
• Diminuer les coûts de fabrication. Par exemple, recycler un déchet métallique évite de devoir extraire les métaux à partir de minerais.
• Economie d’énergie. Pour le verre, l’économie de matière première (sable) n’est pas l’argument majoritaire. Par contre, sa fabrication demande de hautes températures (1500 °C). Pour recycler le verre, les températures atteintes sont plus basses.
Cependant, une difficulté est d’ordre économique : une méthode de recyclage peu rentable financièrement sera forcément de portée limitée dans la vie de tous les jours.
Valorisation des déchets : Certains déchets ne peuvent pas être recyclés. Dans ce cas, il convient de trouver des solutions afin d’éviter qu’ils soient rejetés dans la Nature. L'une d’entre elle est de les valoriser, c'est-à-dire de leur trouver une utilité afin de rendre rentable leur traitement. La valorisation énergétique des déchets via leur combustion est possible pour certains d’entre eux : déchets alimentaires, etc.
Un exemple important est la valorisation du dioxyde de carbone. Ce gaz est rejeté lors de toute combustion, mis à part celle du dihydrogène. Son rôle dans le phénomène de réchauffement climatique a été mis en avant, car c’est un gaz à effet de serre. L’idée est alors à la fois de limiter son rejet dans l’atmosphère terrestre et de rendre sa valorisation économiquement viable.
• Certaines pistes envisagent de le liquéfier est de le stocker dans les fonds marins où dans les gisements pétrolifères épuisés. La pression régnant dans ces deux sites permettrait de le conserver à l’état liquide. Toutefois, la nocivité éventuelle de cette solution (fuite à l’air libre, impact sur l’écosystème) est encore mal connue.
• Exploitation du dioxyde de carbone en tant que fluide réfrigérant, propulseur (bombe aérosol), solvant.
• Notion de réacteur biologique utilisant la photosynthèse, et le dioxyde de carbone comme matière première. Les algues marines présentent un rendement intéressant pour ce type d’application, pouvant alors produire des biocarburants.
Une difficulté pour valoriser le dioxyde de carbone est de pouvoir le capter dès sa production. Si cela est possible au niveau d’installations industrielles, cela semble nettement plus délicat pour les voitures !
• Matières premières : diminuer l’utilisation du pétrole, en le replaçant par des ressources naturelles renouvelables, comme des biocarburants.
• Choix des réactions : la finalité est de diminuer la production de sous-produits inutilisés en choisissant les réactions : notion d’économie d’atomes.
• Optimiser les synthèses chimiques : choix du solvant (plus propre, plus efficace). Notion de chimie douce, qui consiste à travailler dans des conditions les moins exigeantes possibles. Les catalyseurs peuvent rendre possible cette approche.
• Limiter et/ou valoriser les déchets, afin de réduire l’impact environnemental (exemple du dioxyde de carbone).

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








