Identifier une espèce chimique - Tests chimiques
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Savoir que la couleur d’une solution peut donner une indication sur la présence de certains ions.
- Savoir effectuer et interpréter un test à la flamme.
- Savoir effectuer et interpréter un test de caractérisation par précipitation.
Pour identifier la présence de certains ions en solution, on peut :
- directement interpréter la couleur de la solution ;
- effectuer un test à la flamme en interprétant la couleur prise par la flamme lorsqu’on y présente un fil de fer préalablement trempé dans la solution ;
- effectuer une caractérisation par réaction de précipitation en ajoutant quelques gouttes d’un réactif spécifique à la solution et en interprétant la formation ou non d’un précipité.
- Les ions
- La sécurité en chimie
- Le matériel du chimiste – Verrerie
Un test de reconnaissance est utilisé pour confirmer ou infirmer la présence d'une espèce chimique dans un milieu.
Les espèces les plus simples à identifier par des tests chimiques sont les ions. Pour caractériser la présence de certains d’entre eux, on utilise couramment la couleur de la solution, un test à la flamme ou un test de précipitation.
Certains ions donnent une coloration caractéristique à la solution. La couleur d’une solution peut ainsi indiquer la présence d’ions particuliers.
Ce n’est cependant pas une certitude, juste une
indication.
Ainsi :
- Une solution bleue est susceptible de contenir des ions Cu2+ (ions cuivre II).

Une solution de sulfate de cuivre
(Cu2+ + |

Plaque de cuivre oxydée
Le cuivre métallique devient bleu lorsqu’il s’oxyde. Cela est dû à la présence d’ions Cu2+. |
- Une solution vert pâle est susceptible de contenir des ions Fe2+ (ions fer II).

Une solution de sulfate de fer II
(Fe2+ +
|

Sulfate de fer
Le sulfate de fer est notamment utilisé en
jardinerie comme anti-mousse.
|
- Une solution marron (couleur rouille) est susceptible de contenir des ions Fe3+ (ions fer III).

Une solution de chlorure de
fer III (Fe3+ + Cl–)
|

Rouille sur une vieille voiture La couleur de la rouille est due à la
présence
d’ions Fe3+.
|
Un test à la flamme consiste à tremper un fil de fer dans la solution à tester, puis à placer la partie trempée dans une flamme.
La flamme prend une couleur caractéristique avec certains ions.
Si le fil de fer a été trempé dans une solution qui contient des ions sodium (Na+), la flamme devient jaune. C’est le cas de l’eau salée.
Une flamme jaune est caractéristique de la présence d’ions sodium (Na+).

|
Une flamme violette est caractéristique de la présence d’ions potassium K+. 
Caractérisation des
ions K+
|
Une flamme orangée est caractéristique de la présence d’ions calcium Ca2+. 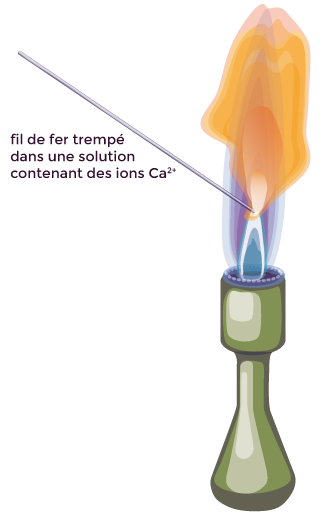
Caractérisation des
ions Ca2+
|
Pour caractériser la présence (ou l’absence) d’un ion dans une solution, on peut y ajouter quelques gouttes d’un réactif spécifique. Il se forme alors un précipité.
Un précipité est une substance gélatineuse colorée qui se forme dans la solution.
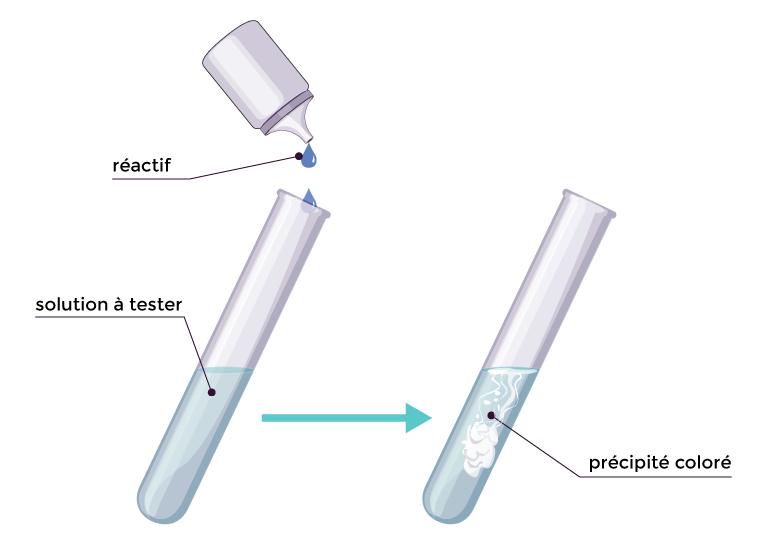
Caractérisation d’ions en solution
Le réactif et la couleur du précipité permet de caractériser la présence de certains ions.
Cependant, l’absence de précipité ne permet pas d’affirmer l’absence de l’ion car il peut être présent en quantité insuffisante pour réagir avec le réactif.
Pour connaitre le réactif à utiliser pour identifier l’ion caractérisé, on peut utiliser le tableau suivant.
Ce tableau indique le réactif adapté pour identifier quelques ions courants.
| Ion à caractériser | Aspect initial | Produit réactif | Observation |
|
Ion sulfate |
Incolore | Chlorure de baryum | Précipité blanc |
| Ion chlorure Cl– | Incolore | Nitrate d'argent | Précipité blanc qui noircit à la lumière |
| Ion potassium K+ | Incolore | Acide picrique | Précipité jaune de cristaux en forme de paillettes |
| Ion calcium Ca2+ | Incolore | Oxalate d'ammonium | Précipité blanc |
| Ion cuivre II (Cu2+) | Bleu | Hydroxyde de sodium | Précipité bleu |
| Ion fer II (Fe2+) | Vert | Hydroxyde de sodium | Précipité vert |
| Ion fer III (Fe3+) | Rouille | Hydroxyde de sodium | Précipité rouille |

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








