Qu'est-ce qu'un composé ionique ?
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Connaitre la différence entre un ion et un composé ionique.
- Savoir qu’un composé ionique est électriquement neutre.
- Savoir interpréter le nom et la formule d’un composé ionique.
- Un composé ionique est un solide qui est constitué d’un empilement régulier d’anions et de cations.
- L’électroneutralité d’un composé ionique est assurée par l’égalité des charges positives et négatives qui la constituent.
- Le nom d’un composé ionique commence par celui de l’anion et se termine par celui du cation.
- La formule d’un composé ionique commence par la formule du cation et se termine par celle de l’anion.
- Les espèces chimiques
- Les ions
Moyen mnémotechnique : le mot « cation » comporte plus (+) de lettres que le mot « anion ».
Il existe :
- des ions monoatomique qui sont constitués d’un seul atome ;
- et des ions polyatomiques qui sont constitués de plusieurs atomes.
- L’ion sodium Na+ est un cation monoatomique qui porte une charge élémentaire positive.
- L’ion sulfate
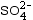 est un
anion polyatomique qui porte 2 charges
élémentaires négatives.
est un
anion polyatomique qui porte 2 charges
élémentaires négatives.
À l’échelle macroscopique, les matériaux solides qui nous entourent ne sont pas chargés électriquement. Il en est de même d’un composé ionique.
Puisqu’un composé ionique est électriquement neutre, il est constitué d’autant de charges négatives (–) que de charges positives (+).
- Le chlorure de sodium (sel de cuisine) est
un composé ionique.
C’est un solide constitué d’un empilement régulier d’ions chlorure Cl– (anions) et d’ions sodium Na+(cations).
Le sel est neutre car il y a autant d’ions chlorure Cl– que d’ions sodium Na+.
Chlorure de sodium - Le fluorure de calcium est un composé
ionique présent dans la nature. Il est la
principale source de fluor.
C’est un solide constitué d’un empilement régulier d’ions fluorure F– (anions) et d’ions calcium Ca2+ (anions).
Pour garantir l’électroneutralité du solide, il faut deux fois plus d’ions fluorure F– que d’ions calcium Ca2+.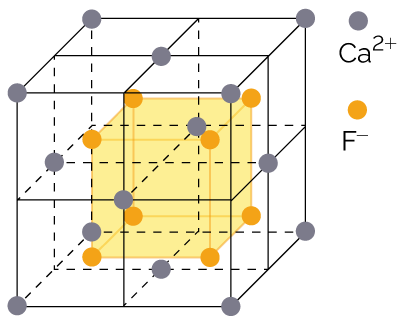
Fluorure de calcium
Un composé ionique n’est pas conducteur de courant électrique car les porteurs de charges (ions) sont immobiles.
Un composé ionique binaire est composé de deux ions : un cation et un anion.
La formule d’un composé ionique binaire est la suivante :
- L’ion positif (cation) figure en premier et l’ion négatif (anion) en second.
- Les charges (+ et –) n’apparaissent pas dans la formule.
- Les nombres placés en indice correspondent
à la proportion de chaque ion pour assurer la
neutralité électrique.
- S’il n’y a pas d’indice, c’est qu’il y a autant de cations que d’anions.
- Si un élément n’a pas d’indice, c’est la valeur « 1 » qui est sous-entendue.
- Le iodure de potassium a pour formule KI.
Le premier élément de la formule donne l’ion positif (K+), et le second donne l’ion négatif (I–).
Puisqu’il n’y a pas d’indice, cela signifie qu’il y autant d’ions K+ (1) que d’ions I– (1). - Le chlorure de calcium a pour
formule CaCl2.
Le premier élément de la formule donne l’ion positif (Ca2+), et le second donne l’ion négatif (Cl–).
L’élément Ca n’a pas d’indice et l’élément Cl a pour indice 2. Il y a donc 2 ions chlorure Cl– pour un ion calcium Ca2+.
Le nom d’un composé ionique binaire indique les ions qui le constituent.
Le nom d’un composé binaire est constitué du nom des ions qui le composent. Contrairement à la formule, le premier terme est le nom de l’anion et le second terme est le nom du cation.
- Le composé ionique nommé
« chlorure d'aluminium » est
formé d’ions
négatifs Cl– (chlorure) et
d’ions positifs Al+ (aluminium).

- Le composé ionique nommé
« oxyde d’aluminium » est
formé d’ions
négatifs O2–
(oxygène) et d’ions
positifs Al3+ (aluminium).


Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








