L'énergie de liaison
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Associer qualitativement l’énergie d’une liaison entre deux atomes à l’énergie nécessaire pour rompre cette liaison.
- Calculer l’énergie de dissociation d’une molécule.
- L’énergie de liaison entre deux atomes A et B est l’énergie qu’il faut fournir à la molécule pour rompre la liaison de valence entre A et B.
- L’énergie de liaison dépend des atomes qui sont présents.
- On peut considérer que l’énergie de dissociation d’une molécule est la somme des énergies de toutes les liaisons dans la molécule.
- La liaison covalente
- Le symbole des principaux atomes
- L’écriture scientifique
On considère une molécule diatomique A–B.
En formant la molécule A–B, les atomes A et B se sont stabilisés.
Les atomes A et B se retrouvent alors indépendants.
Cette énergie de liaison correspond également à l’énergie dégagée lors de la formation de la liaison.
La valeur de cette énergie de liaison dépend des atomes liés.
- L’énergie de liaison de la molécule H–H vaut 7,24 × 10−19 J.
- L’énergie de liaison de la molécule Cl–Cl vaut 4,04 × 10−19 J.
- L’énergie de liaison de la molécule H–Cl vaut 7,18 × 10−19 J.
Il faut donc fournir plus d’énergie pour rompre la liaison H–H que rompre la liaison Cl–Cl ou H–Cl.
Une même liaison entre deux atomes se trouve souvent dans des molécules différentes.
La liaison C–H se trouve par exemple dans les molécules suivantes.

Dans ces molécules, les liaisons C–H ne sont pas entourées des mêmes atomes. Les énergies de liaisons pour dissocier les atomes C et H seront un peu différentes en fonction de la molécule dans laquelle ils se trouvent.
L’énergie de liaison C–H donnée dans les énoncés et ouvrages est donc une valeur moyenne.
- C–H : 6,8 × 10−19 J
- C–C : 5,8 × 10−19 J
- C=C : 10,2 × 10−19 J
- C–O : 5,9 × 10−19 J
- O–H : 7,7 × 10−19 J
Cette somme des énergies est l’énergie nécessaire pour rompre toutes les liaisons de la molécule.
- Le méthane CH4 est
constitué de 4 liaisons
simples C–H.
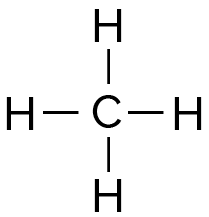
L’énergie pour rompre toutes les liaisons de la molécule de méthane est donc :
E = 4 × 6,8 × 10−19
E = 2,72 × 10−18 J -
L’éthénol C2H4O
est constitué de 3 liaisons
simples C–H,
d’une liaison double C=C,
d’une liaison simple C–O et d’une liaison
simple O–H.
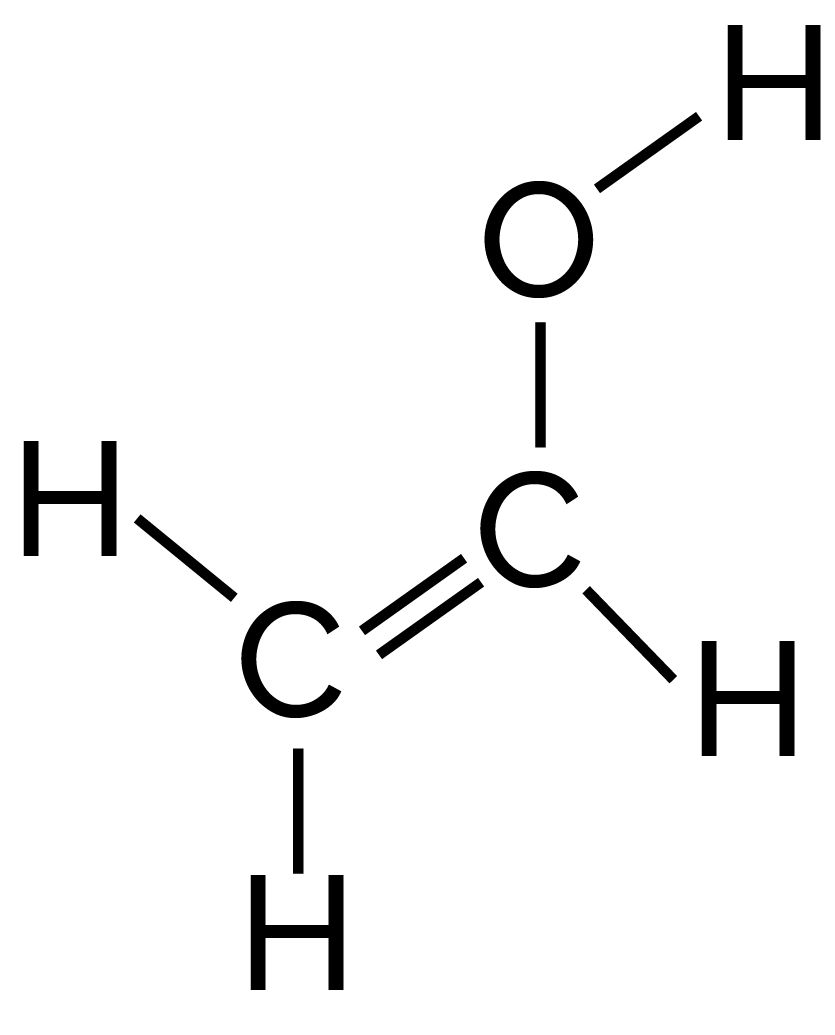
L’énergie pour rompre toutes les liaisons de la molécule d’éthénol est donc : E = 3 × 6,8 × 10−19 + 10,2 × 10−19 + 5,9 × 10−19 + 7,7 × 10−19
E = (3 × 6,8 + 10,2 + 5,9 + 7,7) × 10−19
E = 44,2 × 10−19
E = 4,42 × 10−18 J
Plus l’énergie pour rompre toutes les liaisons d’une molécule est grande, plus la molécule est stable.
La valeur de l’énergie de liaison d’une liaison double n’est toutefois pas égale au double de la valeur de l’énergie de liaison d’une liaison simple : cette valeur est inférieure à son double (ou triple).
Dans le tableau précédent, on constate que l’énergie de la double liaison C=C n’est pas le double de l’énergie de la liaison C–C : 10,2 × 10−19 J < 2 × 5,8 × 10−19 J.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








