Identifier le réactif limitant d'une réaction chimique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Savoir interpréter une équation chimique en termes de quantité de matière.
- Déterminer le réactif limitant lors d’une transformation chimique totale à partir de l’identification des espèces chimiques présentes dans l’état final.
- Les quantités de matière des réactifs consommés et des produits formés sont proportionnelles aux coefficients stœchiométriques de l’équation chimique.
- Le réactif limitant d’une réaction est le réactif qui est totalement consommé à la fin de la réaction.
- Proportionnalité – Produits en croix
- La quantité de matière
On considère ci-dessous l’équation de la réaction de combustion du méthane (gaz de ville).
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
- D’un point de vue microscopique, cette équation signifie que lorsque 1 molécule de méthane (CH4) rencontre 2 molécules de dioxygène (O2), alors il se forme 1 molécule de dioxyde de carbone (CO2) et 2 molécules d’eau (H2O).
-
À l’échelle
macroscopique, on raisonne
en mole :
1 mole de méthane réagit avec 2 moles de dioxygène pour donner 1 mole de dioxyde de carbone et 2 moles d’eau. -
D’un point de vue
pratique, on peut même dire que
:
lorsque 1 mole de méthane disparait, alors 2 moles de dioxygène disparaissent en même temps et 1 mole de dioxyde de carbone apparait avec 2 moles d’eau. -
En allant même plus
loin, puisque le chimiste ne manipule pas
nécessairement un nombre entier de
quantité de matière, on peut
dire que :
lorsque moles de méthane disparaissent avec
2
moles de méthane disparaissent avec
2 moles de dioxygène, il se
forme
moles de dioxygène, il se
forme  moles de dioxyde de carbone et
2
moles de dioxyde de carbone et
2 moles d’eau.
moles d’eau.
Si on fait réagir ![]() moles de méthane et 2
moles de méthane et 2![]() moles de dioxygène, on dit que les
réactifs sont dans les proportions
stœchiométriques,
c’est-à-dire que les deux réactifs
ont été introduits de manière
à être totalement consommés.
moles de dioxygène, on dit que les
réactifs sont dans les proportions
stœchiométriques,
c’est-à-dire que les deux réactifs
ont été introduits de manière
à être totalement consommés.
Faire réagir 0,3 mole de méthane et 0,6 mole de dioxygène, c’est réaliser la réaction chimique dans les proportions stœchiométriques car ce sont les proportions données par les coefficients stoechiométriques 1 et 2 :
1 CH4 + 2 O2 → CO2 + 2 H2O
Lorsque le réactif limitant est consommé, la réaction chimique s’arrête.
Si les réactifs en présence sont dans des proportions stœchiométriques, alors ils sont tous limitants puisqu’ils seront tous totalement consommés à la fin de la réaction.
Si on constate que tous les réactifs ont disparu en fin de réaction, c’est qu’ils étaient dans des proportions stœchiométriques.
Lorsqu’on fait réagir des quantités de matière connues de réactifs, on doit être capable de déterminer lequel sera limitant.
On considère ici qu’il n’y a que deux réactifs.
Pour déterminer le réactif limitant, on utilise la proportionnalité.
- Ne considérer qu’une seule des deux quantités de matière de réactif données par l’énoncé.
- Utiliser les proportions données par les coefficients stœchiométriques pour déterminer la quantité de matière de l’autre réactif nécessaire pour que les proportions stœchiométriques soient respectées.
- Comparer la quantité de matière obtenue pour l’autre réactif à celle fournie par l’énoncé et conclure : ce second réactif est en excès si sa quantité de matière initiale est supérieure à la valeur trouvée, et il est limitant si sa quantité de matière est inférieure.
On utilise 3 moles d’ammoniac NH3 et 4 moles de dioxygène O2 pour réaliser la réaction d’équation :
4 NH3(g) + 5 O2(g) → 4 NO(g) + 6 H2O(l).
Quel est le réactif limitant ? Autrement dit, quel réactif, entre NH3 et O2, va disparaitre en premier ?
- On utilise 3 moles d’ammoniac NH3.
- On cherche la quantité de matière
de dioxygène O2 qui va
réagir avec les 3 moles
d’ammoniac NH3 si la
réaction a lieu dans les proportions
stœchiométriques en utilisant un
tableau de proportionnalité.
On calculeRéactif NH3 O2 Coefficient stœchiométrique 4 moles 5 moles Quantité de matière initiale 3 moles  moles
moles
 à l’aide des produits en
croix :
à l’aide des produits en
croix : 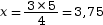 moles.
moles.
- D’après nos calculs, pour que la
réaction ait lieu dans des proportions
stœchiométriques, il faut faire
réagir 3 moles de NH3
avec 3,75 moles de O2.
Or, on dispose de 4 moles de O2, ce qui est trop. Il va rester du dioxygène en fin de réaction.
Le dioxygène est donc en excès tandis que le réactif limitant est l’ammoniac NH3.
Dans l’exemple, on aurait pu considérer les 4 moles de O2 présentes initialement et on aurait déterminé la quantité de matière de NH3 à utiliser pour respecter les proportions stœchiométriques. On serait arrivé à la même conclusion.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








