Des exemples de réactions chimiques
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Modéliser par l’écriture d’une équation de réaction :
- la combustion du carbone et du méthane ;
- la corrosion d’un métal par un acide ;
- l’action d’un acide sur le calcaire ;
- l’action de l’acide chlorhydrique sur l’hydroxyde de sodium en solution.
- Les combustions sont l’action du
dioxygène.
- Combustion du carbone :
C(s) + O2(g) → CO2(g) - Combustion du méthane :
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l)
- Combustion du carbone :
- Certains métaux réagissent avec les
ions H+ des acides.
- Le fer :
Fe(s) + 2 H+(aq) → Fe2+(aq) + H2(g) - L’aluminium :
Al(s) + 6 H+(aq) → 2 Al3+(aq) + 3 H2(g)
- Le fer :
- Les acides réagissent avec le carbonate de
calcium (CaCO3) du calcaire suivant la
réaction suivante :
CaCO3(s) + 2 H+(aq) → Ca2+(aq) + CO2(g) + H2O(l) - L’acide chlorhydrique et la soude
réagissent pour former de l’eau
salée :
(H+ + Cl−)(aq) + (Na+ + OH−)(aq) → H2O(l) + Na+(aq) + Cl−(aq)
Si on n’écrit pas les ions spectateurs, l’équation devient :
H+(aq) + OH−(aq) → H2O(l)
- Réactifs et produits
- Ajuster une équation chimique
Voici les réactions chimiques qui sont à connaitre en classe de seconde.
Dans notre entourage, on peut tous les jours observer des réactions de combustion : la flamme d’un réchaud à gaz, une bougie qui brule, une allumette enflammée, etc.
Ce que l’on appelle bruler est une réaction de combustion. Les combustions dégagent de l’énergie sous différentes formes : lumière, chaleur, etc., mais d’autres combustions sont moins visibles, comme respirer ou encore manger, qui sont en effet des réactions de combustion qui dégagent de l’énergie.
Le carbone, élément de symbole C, est largement répandu dans la nature. Il est nécessaire à l’existence des organismes vivants et a de nombreuses applications dans l’industrie.
Il se trouve principalement sous forme de charbon, mais sa diversité de structure lui permet de s’associer sous d’autres formes : graphite, diamant, etc.
La combustion du carbone a l’équation chimique suivante.
Les réactifs sont le carbone et le dioxygène. Le produit est le dioxyde de carbone.
Pour déclencher la combustion, il est nécessaire d’apporter de l’énergie (allumer les braises).
Le méthane est un hydrocarbure (constitué de carbone et d’hydrogène) de formule brute CH4. C’est le principal constituant du gaz de ville.
La combustion du méthane a l’équation chimique suivante.
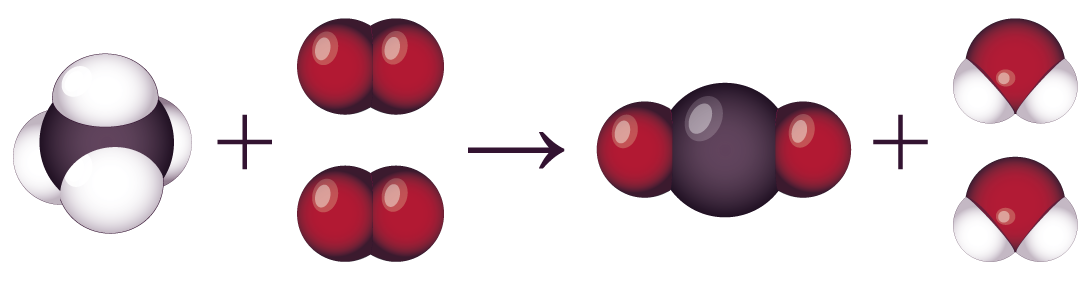
Modélisation moléculaire de l’équation de combustion du méthane
Les réactifs sont le méthane CH4 et le dioxygène O2.
Les produits sont le dioxyde de carbone CO2 et l’eau H2O.
La corrosion d’un métal désigne son altération lorsqu’il réagit en présence d’une espèce chimique comme le dioxygène ou les acides.
Dans ces réactions, les métaux passent en solution sous forme de cations avec un dégagement de dihydrogène H2 (gaz explosif).
- Équation de la réaction du fer et d’un acide :
- Équation de la réaction de l’aluminium et d’un acide :
Il est courant de détartrer une cafetière avec du vinaigre blanc.
La réaction mise en jeu est l’action de l’acide (vinaigre) sur le calcaire (tartre).
Le calcaire est principalement constitué de carbonate de calcium CaCO3 solide. Lors de la réaction avec les ions H+ des acides, il se forme notamment du dioxyde de carbone gazeux (CO2) qui crée une effervescence.
L’équation de la réaction est la suivante.
L’acide chlorhydrique en solution est formé d’ions H+ et Cl−. Comme son nom l’indique, c’est un acide.
L’hydroxyde de sodium en solution est formé d’ions OH− et Cl−. C’est une base.
L’équation de la réaction chimique entre l’acide chlorhydrique (H+ + Cl−)(aq) et la soude (Na+ + OH−)(aq) s’écrit de la manière suivante.
Le produit de la réaction est H2O + Na+ + Cl−. C’est du chlorure de sodium en solution. C’est donc de l’eau salée qui est une solution neutre (pH = 7).
Les ions chlorure Cl− et les ions sodium Na+ sont à la fois dans les réactifs et dans les produits. Ils ne participent pas à la réaction. On dit que ce sont des ions spectateurs.
Il n’est pas nécessaire de faire apparaitre les ions spectateurs dans l’équation de la réaction.
L’équation est alors la suivante.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








