La formation des ions monoatomiques
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Connaitre le lien entre stabilité chimique et configuration électronique d’un gaz noble.
- Déterminer la charge électrique d’ions monoatomiques courants à partir du tableau périodique.
- Nommer les ions et écrire leur formule à partir de leur nom.
- Les éléments de la dernière colonne du tableau périodique forment la famille des gaz nobles.
- Les gaz nobles sont des éléments très stables car ils ont leur dernière couche électronique saturée.
- Au cours des réactions chimiques, les atomes cherchent à acquérir la structure électronique du gaz noble le plus proche, en perdant ou en gagnant des électrons.
- Les ions monoatomiques
- La configuration électronique d’un atome
- L’écriture conventionnelle d’un noyau
- Le tableau périodique et les familles chimiques
Ils ont la particularité d’être très stables, c’est-à-dire qu’ils ne participent à aucune réaction chimique et qu’ils ne forment pas d’ions ou de molécules.
Ils existent principalement sous forme le gaz monoatomique.
La stabilité des gaz nobles est due au fait qu’ils ont leur couche de valence saturée (2 électrons pour l’hélium et 8 pour les autres gaz nobles).
Configuration électronique de 3 gaz nobles :
- Hélium He : 1s2
- Néon Ne : 1s2 2s2 2p6
- Argon Ar : 1s2 2s2 2p6 3s2 3p6
Au cours d’une réaction chimique, un atome tend à gagner en stabilité et va donc saturer (remplir) sa dernière couche électronique, sa couche de valence.
L’atome va pour cela perdre ou gagner des électrons de façon à saturer sa couche de valence.
- Un atome X qui perd
n électrons devient chargé
+ (plus,
positif).
Le cation (ion de charge positive) qui correspond se note Xn+. - Un atome X qui gagne
n électrons devient
chargé –.
L’anion (ion de charge négative) qui correspond se note Xn−.
Voici la méthode pour déterminer l’ion monoatomique qu’un atome peut former.
- Identifier entre quels gaz nobles se trouve l’atome en termes de numéro atomique.
- L’atome va acquérir la structure
électronique du gaz noble le plus proche en termes
de numéro atomique.
- S’il doit gagner un ou plusieurs électrons, l’atome va devenir un anion, chargé négativement.
- S’il doit perdre un ou plusieurs électrons, l’atome va devenir un cation, chargé positivement.
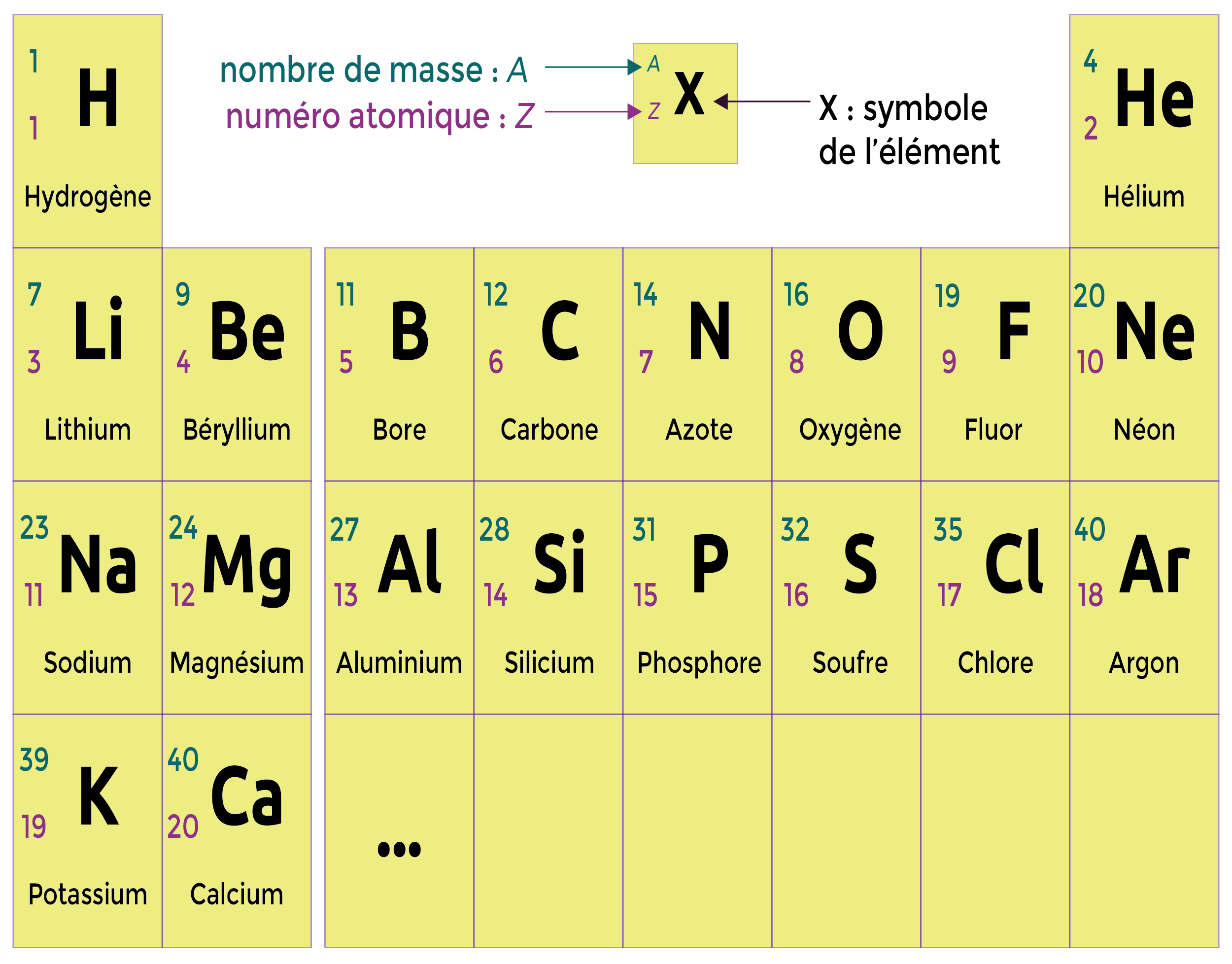
Tableau périodique simplifié
L’atome de chlore Cl a pour numéro atomique Z = 17.
Le numéro atomique du chlore est compris entre celui du gaz noble néon Ne (Z = 10) et celui du gaz noble argon Ar (Z = 18). Le numéro atomique du chlore est plus proche du numéro atomique de l’argon.
Pour acquérir la structure électronique de l’argon, le chlore doit donc gagner 1 électron.
L’atome de chlore ne sera plus électriquement neutre, mais chargé (1−).
L’atome de chlore devient alors l’ion chlorure Cl− (un anion).
L’atome de magnésium Mg a pour numéro atomique Z = 12.
Le numéro atomique du magnésium est compris celui du gaz noble néon Ne (Z = 10) et celui du gaz noble argon Ar (Z = 18). Le numéro atomique du magnésium est plus proche du numéro atomique du néon.
Pour acquérir la structure électronique du néon, le magnésium doit donc perdre 2 électrons.
L’atome de magnésium ne sera plus électriquement neutre, mais chargé (2+).
L’atome de magnésium devient alors l’ion magnésium Mg2+(un cation).
L’atome d’hydrogène H est un cas particulier qui n’obéit pas à cette règle : il forme l’ion hydrogène H+.
Le tableau ci-dessous donne quelques ions monoatomiques dont la formule et le nom sont à connaitre.
| Atome | Gaz noble le plus proche | Nombre d’électrons gagnés ou perdus par l’atome pour acquérir la structure du gaz noble le plus proche | Ion obtenu |
|
Sodium Na Z = 11 |
Néon Ne Z = 10 |
1 électron à perdre |
Ion sodium Na+ |
|
Potassium K Z = 19 |
Argon Ar Z = 18 |
1 électron à perdre |
Ion potassium K+ |
|
Calcium Ca Z = 20 |
Argon Ar Z = 18 |
2 électrons à perdre |
Ion calcium Ca2+ |
|
Magnésium Mg Z = 12 |
Néon Ne Z = 10 |
2 électrons à perdre |
Ion magnésium Mg2+ |
|
Chlore Cl Z = 17 |
Argon Ar Z = 18 |
1 électron à gagner |
Ion chlorure Cl− |
|
Fluor F Z = 9 |
Néon Ne Z = 10 |
1 électron à gagner |
Ion fluorure F− |

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








