Exploiter un diagramme de niveaux d'énergie
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Exploiter un diagramme de niveaux d’énergie en
utilisant les relations ![]() et |ΔE| = hν.
et |ΔE| = hν.
- Les atomes ne peuvent occuper que certains niveaux d’énergie : l’énergie est quantifiée.
- Le diagramme de niveaux d’énergie a la
forme suivante.
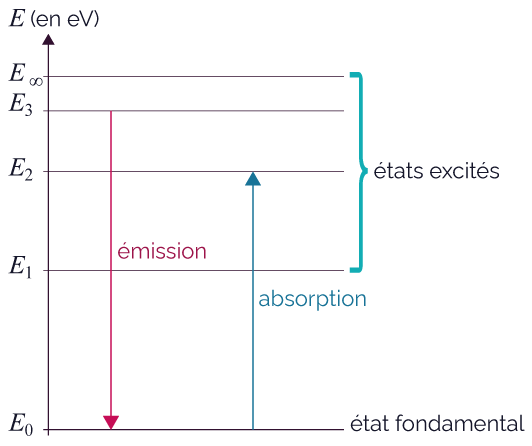
- Un atome dans un état d’énergie E2 peut passer à un état d’énergie plus faible E1 en émettant un photon d’énergie |ΔE| = |E2 − E1|.
- De la même manière, un atome peut passer d’un état d’énergie E1 à un niveau d’énergie plus forte E2 s’il absorbe un photon d’énergie |ΔE| = |E2 − E1|.
- Relation entre longueur d’onde et fréquence
- Relation entre l’énergie, la longueur d’onde et la fréquence
- Spectre de raies d’émission et d’absorption
Un gaz confiné dans une enceinte hermétique est soumis à des décharges électriques. Le gaz produit alors un rayonnement, qui est envoyé sur un prisme pour le décomposer et obtenir son spectre. Celui-ci est composé de raies brillantes.
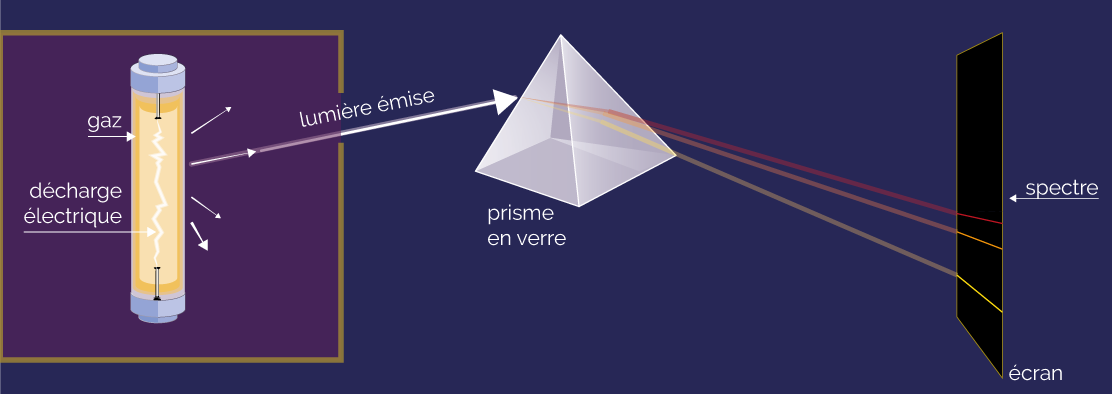
Spectre d’émission d’un gaz
Le spectre obtenu est nommé spectre d’émission du gaz étudié. Il est différent d’un gaz à l’autre.
Un gaz contenu dans une enceinte est éclairé par une lumière blanche puissante. La lumière transmise par le gaz est envoyée sur un prisme pour obtenir son spectre.
Ce spectre se présente comme le spectre de la lumière blanche (bandes continues), mis à part la présence de raies sombres, nommées raies noires, ou raies d’absorption.
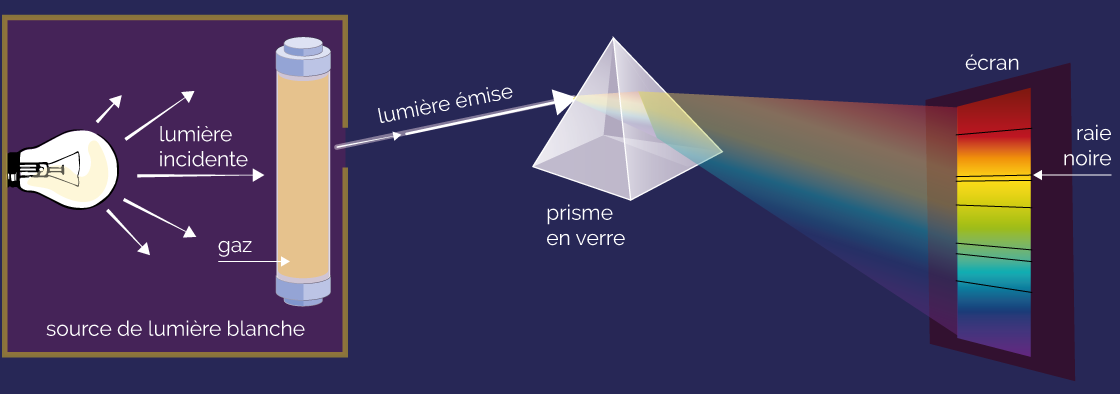
Spectre d’absorption d’un gaz
Le spectre obtenu est le spectre d’absorption du gaz. Comme pour le spectre d’émission, il change d’un gaz à l’autre.
Soit une radiation lumineuse de fréquence ν (nu) constituée de photons.
Chaque photon a une énergie qui est donnée par la relation de Planck, donnée ci-dessous.
|
E = h × ν |
avec :
|
L’énergie d’un photon s’exprime aussi en fonction de la longueur d’onde de la radiation.
|
|
avec :
|
Si en mécanique classique l’énergie d’un système physique peut être plus ou moins quelconque, ce comportement ne se vérifie pas à l’échelle de l’atome.
Afin de représenter les niveaux d’énergie d’un atome, on fait appel à des diagrammes d’énergies.
Voici ci-dessous le diagramme simplifié d’un atome de lithium.
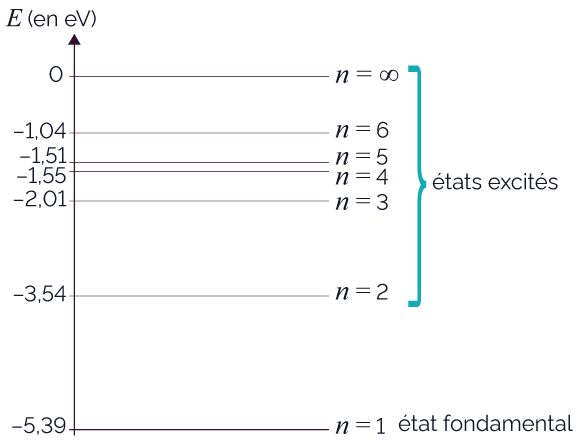
Diagramme d’énergie du lithium
Dans un diagramme d’énergie, les énergies des différents niveaux sont exprimées en électronvolt : 1 eV = 1,601 × 10−19 J.
L’état le plus bas est appelé état fondamental.
Pour le lithium, l’énergie de l’état fondamental est de −5,39 eV.
Les autres états d’énergie sont appelés « états excités ».
Les états d’énergie sont conventionnellement d’énergies négatives, et sont repérés par des numéros : n = 1, n = 2, etc.
On dit que les états d’énergie sont quantifiés.
Les diagrammes d’énergie ne sont pas les mêmes pour deux atomes différents : le diagramme d’énergie d’un atome est ainsi sa « carte d’identité ».
Peu de temps après, ces atomes vont revenir sur le niveau le plus bas en perdant de l’énergie, ce qui se matérialise sous la forme d'émission de photons.
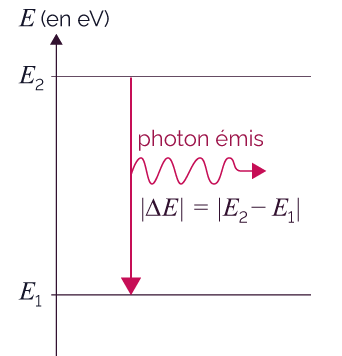 Émission d’un
photon
Émission d’un
photon
Dans le diagramme ci-dessus, le photon
résultant de la transition d’un
état d’énergie E2 vers un
état d’énergie E1 a une
énergie |ΔE|
= |E2 −
E1|.
La longueur
d’onde du photon émis
vaut ![]() .
.
Si l’atome permet plusieurs transitions différentes entre 3 états d’énergie ou plus, il y aura plusieurs longueurs d’onde différentes émises qui constitueront le spectre de raies brillantes.
Si un atome passe d’un état E3 à un état E1, 3 photons de 3 longueurs différentes sont émis.
Ces longueurs d’onde proviennent de :
- la transition d’un état d’énergie E2 vers un état d’énergie E1 ;
- la transition d’un état d’énergie E3 vers un état d’énergie E1 ;
- la transition d’un état d’énergie E3 vers un état d’énergie E2.
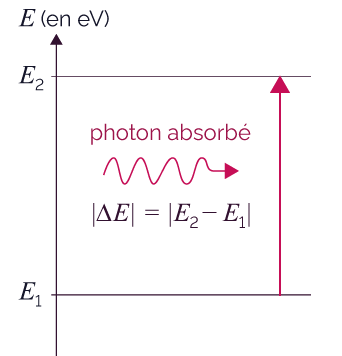
Absorption d’un photon
Dans le diagramme ci-dessus, le photon est absorbé par l’atome parce qu’il a exactement l’énergie requise |E2 − E1| qui correspond à la transition de l’état d’énergie E1 vers l’état d’énergie E2.
Il a alors une énergie |ΔE| ![]() .
.
La longueur d’onde du photon absorbé
vaut ![]() .
.
Pour le spectre d’absorption, l’exposition du gaz à de la lumière blanche fait que les photons incidents vont présenter toutes les longueurs d’onde du visible.
Seuls les photons qui pourront provoquer une transition vers un état plus élevé seront absorbés par un atome. Ces photons seront certes réémis par désexcitation, mais dans des directions aléatoires autres que la direction incidente qu’ils avaient lorsqu’ils ont été émis. Ceci explique le spectre d’absorption trouvé, qui est constitué de raies noires.
Une raie noire correspond à une radiation qui a été absorbée par l’atome. C’est pour cette raison qu’on visualise un ou plusieurs « traits » noirs sur le spectre.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








