Choix raisonné d'un protocole expérimental en chimie organique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
• Choix des réactifs : plusieurs réactifs différents peuvent permettre la synthèse du composé voulu. Le choix peut être dicté par des considérations économiques : préférer un réactif plutôt qu’un autre en fonction de son prix. Suivant la quantité à synthétiser, on estimera alors les quantités de réactifs nécessaires. Le réactif le plus cher devrait être le réactif limitant.
• Utilisation d’un solvant approprié. Si les deux réactifs ne sont pas miscibles, le solvant doit pouvoir les faire coexister dans une phase commune.
• Aspects sécurité et environnemental en ce qui concerne le choix des réactifs et solvants. Éviter si possible tout produit dangereux, toxique, nuisible pour l’environnement. Sinon, prendre les précautions d’usage : hôte aspirante, récupération des déchets dans des bacs appropriés, etc.
• La réaction en elle-même. Des réactions totales sont souvent préférables, car elles évitent le gaspillage de réactifs. D’autre part, une réaction rapide est idéale, car elle minimise le temps de la manipulation. Si ce n’est pas le cas, il faut l’accélérer.
• Utilisation éventuelle d’un catalyseur. Le coût, l’efficacité et l’état physique (poudre, liquide …) sont des aspects à prendre en compte.
• Chauffage du milieu réactionnel, là aussi pour accélérer la réaction. Il convient alors d’estimer l’intensité de chauffage requise. Un chauffage insuffisant induira un rendement faible et/ou un temps de réaction trop long. Un chauffage excessif présente un risque d’emballement de la réaction, de perte de réactifs par ébullition trop forte, de dénaturer les composés utilisés (SVT) et un gaspillage énergétique.
Selon l’intensité de chauffage requis, deux montages sont envisageables :
→ Le chauffage à reflux dans le cas d’un chauffage soutenu.
Exemple : synthèse d’un ester avec un acide et un alcool.
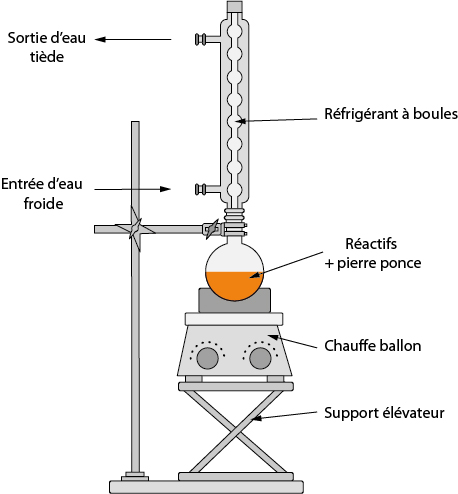
Le rôle de la pierre ponce est de favoriser la formation de bulles, ce qui permet de réguler le chauffage (quand il y a ébullition, la température se stabilise). Le support élévateur permet de faire descendre le chauffe-ballon, et ainsi de stopper rapidement le chauffage en cas de besoin.
→ Un chauffage au bain-marie, dans le cas d’un chauffage modéré, à température contrôlée. Exemple : synthèse de l’aspirine ou du paracétamol.
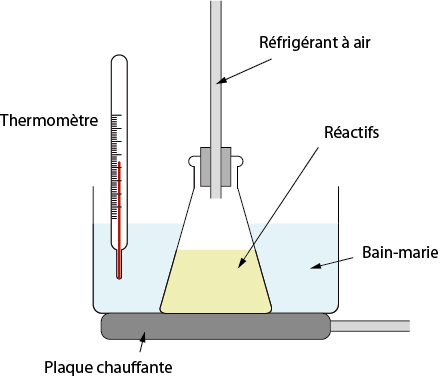
Pour les deux montages, le rôle du réfrigérant est de condenser les vapeurs de réactifs, afin qu’elles retournent dans le milieu réactionnel. L’efficacité d’un réfrigérant dépend de son type : réfrigérant à boules très efficace, réfrigérant à air moins performant.
• Extraction liquide-liquide, pour récupérer une espèce chimique se présentant sous forme liquide, se trouvant elle-même en phase liquide. Le principe de la manipulation est de laisser reposer la solution dans une ampoule à décanter. Il se forme alors deux phases, souvent une phase aqueuse et une phase organique.
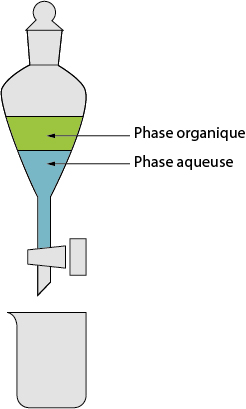
Deux cas possibles :
→ L’espèce chimique à extraire présente une densité assez différente de celle de l’autre phase. Exemple : un ester par rapport à l’eau. On récupèrera alors la phase organique formée par l’ester.
→ On rajoute un solvant de telle manière que l’espèce chimique à extraire présente de fortes affinités avec notre solvant, mais peu avec le reste de la solution. On récupèrera la phase formée par le solvant. Naturellement, cela suppose que ledit solvant ait une densité assez différente de celle du reste de la solution.
• Filtration sous vide avec entonnoir Büchner, pour extraire une espèce chimique solide se trouvant dans la solution. A l’aide d’un papier filtre et de l’aspiration créée par le montage, la phase solide et la phase liquide sont séparées.
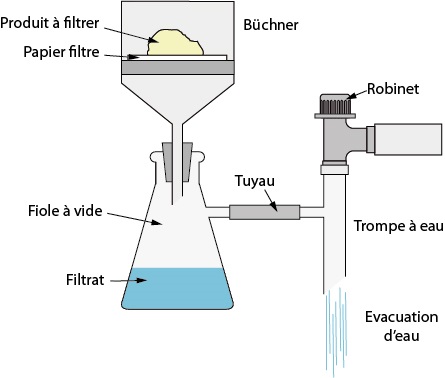
La solubilité de l’espèce solide dépend de la température. Souvent, elle a tendance à diminuer à basses températures. Ainsi, en refroidissant la solution à traiter avant filtration Büchner, l’espèce à extraire cristallise, ce qui rend possible son extraction.
Pour ces deux méthodes, on peut quelquefois favoriser la séparation entre phases ou solide/liquide par relargage. Par exemple, lors de la fabrication d’un savon (saponification), cela consiste à rajouter du chlorure de sodium (sel de cuisine) au mélange, ce qui favorise la formation d’une phase solide, à la surface de la solution, associée au savon.
• Distillation fractionnée, pour une espèce chimique en phase liquide. Cette méthode suppose que ladite espèce ait une température d’ébullition différente de celles des autres espèces présentes en solution.
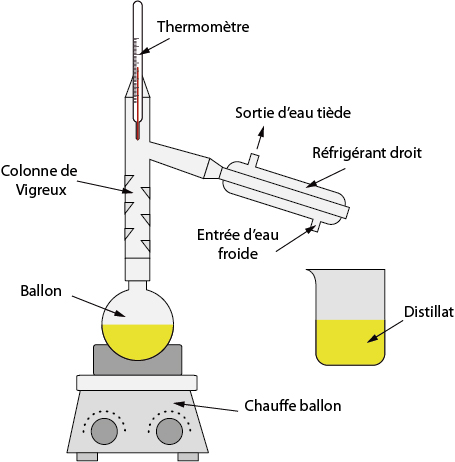
Il est important que la température du mélange soit contrôlée tout au long de la manipulation, afin d’éviter que toutes les espèces chimiques ne soient portées à ébullition, ce qui rendrait vaine cette opération.
Remarque (hors programme) : certains mélanges de deux corps purs, dans des proportions bien précises, peuvent donner un mélange azéotropique, qui a la propriété de ne pas être séparable par une simple distillation.
• Recristallisation. Cette opération est applicable à des espèces chimiques solides. Elle consiste à dissoudre à chaud le solide à traiter. Ensuite, le mélange est refroidi, ce qui provoque la recristallisation du solide. Les impuretés initialement présentes dans le produit restent en solution. Par filtration sous vide, on récupère alors notre solide débarrassé desdites impuretés. Cette méthode repose bien entendu sur l’efficacité du solvant à remplir le rôle que l’on lui assigne (solubilité forte de notre espèce chimique à chaud, mais aussi plus faible à froid).
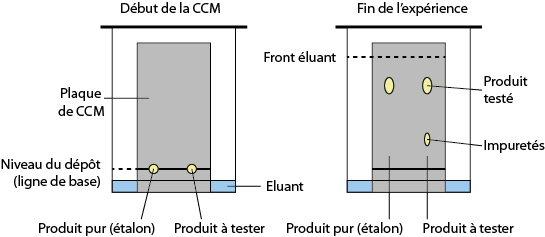
→ Chromatographie sur couche mince (CCM), dans le cas d’un composé en phase liquide. L’exemple ci-dessous révèle la présence d’impuretés dans le produit synthétisé.
→ Spectroscopie (voir fiches dédiées).
→ Banc Kofler, pour un solide. Ce banc présente une variation de température le long de sa surface. En y déposant notre échantillon solide, on peut alors voir pour quelle température celui-ci commence à fondre. Si cette température correspond à celle vue dans la littérature, il est pur. Sinon, il comporte des impuretés (qui ont une température de fusion différente de notre composé synthétisé).
→ Autres tests : mesure de la masse volumique du produit formé, tests mettant en évidence (ou pas) des traces de réactifs, etc.
• Aspect quantitatif : estimation du rendement
• La réaction de synthèse en elle-même, où il faut réfléchir en amont à certains aspects : choix des réactifs, quantités mises en jeu, utilisation d’un solvant, d’un catalyseur. Selon l’intensité de chauffage requise, choix du montage : chauffage à reflux, bain-marie.
• Extraction du composé synthétisé. Selon son état physique (solide/liquide) ou ses propriétés physico-chimiques (densité, solubilité dans tel ou tel solvant), on choisit alors la technique à mettre en œuvre : extraction liquide-liquide, filtration sous vide.
• Purification, afin de se débarrasser d’éventuelles impuretés (traces de réactifs, de solvant..). Là aussi, diverses techniques existent : distillation fractionnée, recristallisation…
• Contrôle de qualité. Afin d’estimer la pureté du produit, on fait appel à des tests : chromatographie sur couche mince, spectroscopie, banc Kofler. Aussi, on calcule le rendement de la manipulation par la relation

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








