Principe des techniques d'analyse utilisées en cinétique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Quelles sont les différentes techniques d'analyse qui permettent de suivre l'évolution temporelle d'un système chimique ?
La solution perd progressivement sa coloration brune. La solution est incolore au bout de plusieurs minutes, car le diiode disparaît au cours de la transformation.
La réaction d'oxydoréduction met en jeu les couples I2 / I- et Fe2+ / Fe.
L'équation de la réaction d'oxydoréduction s'écrit :
I2 (aq) + Fe (s) = 2 I-(aq) + Fe2+(aq) .
Cette transformation est lente.
• Le suivi par titrage, qui permet de déterminer l'évolution de la quantité de diiode I2 présente en solution en fonction du temps.
• Le suivi par spectrophotométrie, qui permet de déterminer l'évolution de l'absorbance A de la solution en fonction du temps.
• Le suivi par conductimétrie, qui permet de déterminer l'évolution de la conductance de la solution en fonction du temps.
Remarque : une transformation chimique dans laquelle un gaz intervient peut être suivie par pressiométrie (ou manométrie), ce qui permet de déterminer l'évolution de la pression du gaz en fonction du temps.
Ces grandeurs physiques peuvent ensuite être reliées à la concentration en diiode, ou à l'avancement x de la réaction.
On prélève à une date t un échantillon de la solution, et on procède à une trempe (dilution et refroidissement rapide de la solution) pour stopper la transformation.
Le prélèvement est introduit dans un bêcher.
On verse ensuite dans le bêcher une solution de thiosulfate de sodium contenue dans une burette graduée, jusqu'à atteindre l'équivalence (repérée par une disparition de la couleur brune de la solution).
Pour plus de commodité, on introduit dans le mélange, lorsque la solution est jaune pâle, de l'empois d'amidon ; la coloration bleue que prend le mélange est plus visible que le jaune. Le changement de couleur est plus net.
La transformation qui se produit est totale et rapide, c'est pourquoi elle peut servir de support au dosage.
L'équation de cette transformation s'écrit :
I2(aq) + 2 S2O32-(aq) = 2 I-(aq) + S4O62-(aq) .
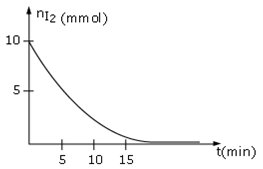
Le volume VE versé pour atteindre l'équivalence permet de calculer la quantité nI2 de diiode présente dans l'échantillon, et donc dans la solution.
On a, à l'équivalence, à la date t :
En répétant la manipulation à différentes dates, on peut ainsi tracer la courbe d'évolution de la quantité de diiode formée en fonction du temps.
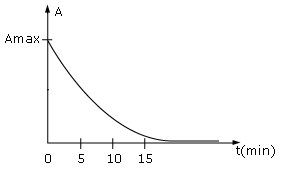
L'absorbance A de la solution étudiée est proportionnelle à la concentration en diiode de la solution.
Pour étudier l'évolution temporelle de la réaction, on place un échantillon de la solution dans une cuve que l'on place dans un spectrophotomètre.
À différentes dates t, on relève la valeur de l'absorbance A donnée par l'appareil.
Le tracé d'une courbe A = f (t) permet d'étudier l'évolution du système.
On relie ensuite l'absorbance A à la concentration en diiode de la solution.
En effet,
Le tracé d'une courbe G = f (t) permet d'étudier l'évolution du système.
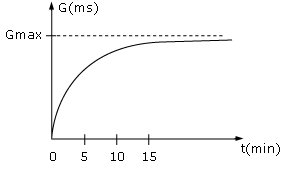
On relie ensuite la conductance G à l'avancement x de la réaction.
En effet,
Soit
Et donc
En effet, la présence de certaines espèces chimiques peut être mise en évidence par révélation UV. On peut ainsi déterminer à quelles dates les espèces apparaissent ou disparaissent du mélange réactionnel.
À plusieurs dates t, on prélève un échantillon du système et on en dépose une goutte sur une plaque de CCM.
Quand l’élution est terminée, on repère le front de l’éluant, on sèche et on révèle la plaque sous UV en repérant la présence des taches.
La comparaison des taches sur les plaques permet de déterminer approximativement la date à laquelle le système a cessé d’évoluer.
• La grandeur physique (conductance, absorbance, pression, etc.) ou la grandeur chimique (quantité de matière, concentration) qui varient au cours du temps, peuvent être reliées à l'avancement x de la réaction pour en étudier l'évolution.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








