Matériaux structurels : membranes, colles, adhésifs
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Les membranes des cellules animales assurent certaines fonctions structurelles, dont :
• Définir une enceinte fermée, la cellule, en empêchant des espèces chimiques comme l’eau ou des ions d’entrer ou sortir librement. Des échanges ont tout de même lieu avec le milieu extérieur, mais via des structures dédiées : pont d’ions …
• Etre assez rigide pour résister aux agressions mécaniques extérieures, en gardant une certaine cohésion et en maintenant la forme et la structure de la cellule.
• Etre assez souple : lorsque la cellule se divise (mitose, méiose), la membrane se déforme, puis se fractionne pour englober les deux nouvelles cellules.
• Pouvoir fusionner avec d’autres membranes : exocytose, fécondation…
• Si la membrane est déchirée, elle peut se réparer (dans une certaine mesure) et refermer la brèche.
Ces propriétés de la membrane cellulaire, nommée aussi membrane plasmique, sont assurées par des phospholipides. Un exemple est donné ci-dessous :
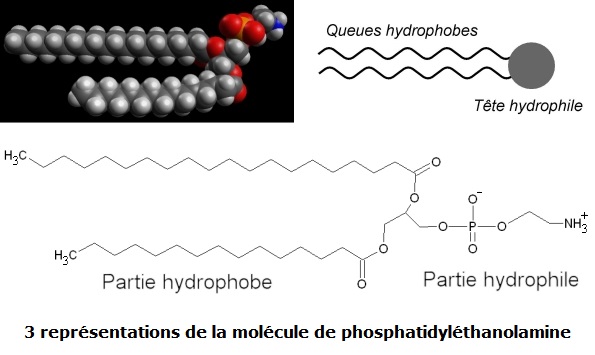
Globalement, ces molécules comprennent deux parties :
→ Deux chaines carbonées linéaires comportant entre 14 et 24 atomes de carbone. Elles sont apolaires, pouvant ainsi donner lieu à des liaisons intermoléculaires de type Van de Waals. Elles n’ont aucune affinité avec l’eau : elles sont hydrophobes. Une des deux chaines peut avoir une double liaison
→ Une extrémité des molécules comporte deux fonctions ester, un groupement phosphate
Un phospholipide, y compris la phosphatidyléthanolamine, est un zwitterion en conditions normales, c'est-à-dire qu’il porte une charge positive et une charge négative, de sorte que la molécule reste globalement neutre électriquement.
Les phospholipides ont à la fois un comportement hydrophile et hydrophobe. On dit qu’ils sont amphiphiles. Dans la membrane plasmique, ils sont organisés en une double couche. Les queues hydrophobes sont dirigées vers l’intérieur de la membrane, parallèlement les unes aux autres. Les têtes hydrophiles sont tournées vers le milieu extérieur de la cellule d’une part, et vers l’intérieur de celle-ci d’autre part. Cette structure n’est pas statique : les molécules d’une même couche bougent sans cesse les unes par rapport aux autres.
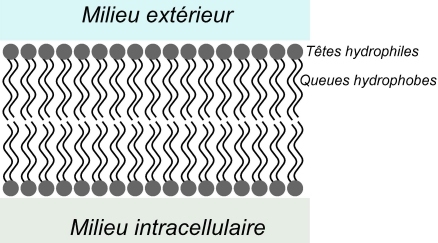
Plus la membrane comporte de longues chaines carbonées saturées (sans double liaison), plus elle est rigide : l’alignement des queues hydrophobes optimise la création de liaisons de Van der Waals. Au contraire, la présence de doubles liaisons
Les liposomes
Les liposomes sont des structures synthétisées par l’Homme. Ils sont de forme sphérique et sont plus petits qu’une cellule. Ils sont formés par une bicouche de phospholipides, comme la membrane plasmique. Le centre du liposome forme une cavité de quelques dizaines de nanomètres de diamètre ; elle est remplie d’une phase aqueuse.
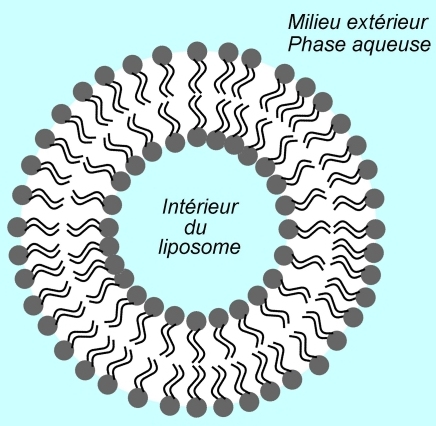
La vocation des liposomes est de contenir et de véhiculer une espèce chimique, comme un médicament. On parle de vecteur du médicament. Si celui-ci est en phase aqueuse (il est hydrophile), alors il sera stocké dans la cavité. S’il est hydrophobe, alors il peut être mis dans la bicouche elle-même.
De part sa ressemblance avec la paroi cellulaire, le liposome peut fusionner avec elle. L’espèce chimique véhiculée est directement libérée dans la cellule. La substance aurait eu plus de mal à atteindre la cellule et franchir sa membrane sans le liposome. Par contre, il n’y a pas de ciblage des cellules réceptrices. Mis à part les applications médicales, les liposomes sont aussi employés en cosmétique, notamment pour des soins de la peau.
Il existe une variante des liposomes, les niosomes, où les phospholipides sont remplacés par du cholestérol et des polyglycérols, qui ne comportent eux qu’une seule chaine carbonée. Les niosomes sont plus petits que les liposomes.
Remarque : Dans la fiche dédiée aux tensioactifs, nous verrons des similitudes entre les molécules constituant les membranes et les molécules de savon. Les liposomes (bicouches) pourront aussi être comparés aux micelles (simple couche).
Membranes de synthèse en chimie
Dans l’industrie chimique, il existe des membranes de synthèse de différentes sortes. On rencontre des membranes polymères, ou éventuellement des membranes céramiques. Leur finalité est de ne laisser passer que certaines espèces chimiques, et pas d’autres, un peu à la manière d’un tamis, mais à une échelle moléculaire. Quelques applications pratiques :
• Extraction ou séparation industrielle : la membrane peut permettre d’extraire ou de séparer des espèces chimiques. Selon les molécules à récupérer, on peut jouer sur la taille des pores de la membrane, de son éventuel caractère polaire, etc.
• Purification d’eau par osmose inverse, évoquée dans une précédente fiche. Les pores de la membrane sont assez fins pour ne laisser passer que les molécules d’eau.
• En médecine : dialyse, c'est-à-dire purification du sang du patient, lorsque ses reins ne fonctionnent pas assez bien pour assurer cette fonction.
Durant la préhistoire, l’Homme avait découvert que le bitume pouvait lui permettre de fixer des pointes au bout de ses flèches. Plus tard, il découvrit que diverses substances naturelles pouvaient être utilisées comme colles. On a ainsi des substances :
• minérales, comme du soufre fondu puis refroidi.
• végétales : résines végétales, sève d’arbres, gomme arabique, latex, amidon, cellulose, huile d’amande amère.
• animales : blanc d’œufs, colle de peau de lapin, colle de poisson, … le collagène est notamment utilisable comme colle.
L’emploi de matériaux de synthèse ne date réellement que de la fin XIXème, et du XXème siècle, avec la mise au point des colles modernes. Ces dernières ont sérieusement concurrencé les colles naturelles pour des applications domestiques ou industrielles. Mais, les colles naturelles restent très employées dans certains secteurs : collage du bois, papier …, ou dans des domaines artistiques.
Principe d’action de la colle
La colle permet de lier deux matériaux. La colle étalée sur une des surfaces à coller va se répandre, en remplissant les moindres défauts et aspérités. La finalité est de « combler les vides » quand les deux surfaces seront pressées l’une contre l’autre, et de maximiser la surface de contact entre le film de colle et les surfaces à coller. Ensuite, la colle « sèche » et durcit. Selon le type de colle, cela peut se faire de différentes manières.
D’un point de vue chimique, les molécules de colle établissent des liaisons entre elles et avec les atomes des surfaces à lier. Ces liaisons peuvent être covalentes, ioniques ou intermoléculaires (liaisons hydrogène ou Van der Waals). Bien sûr, plus la surface de contact colle/matériau est forte, plus les liaisons seront nombreuses et le collage efficace.
Toutes les colles n’ont pas la même efficacité. Celle-ci peut exprimer l’énergie à apporter pour séparer deux surfaces collées sur une certaine surface ; on parlera alors en
Adhésifs à mise en œuvre physique (AMOP) :
→ Colles où les molécules servant au collage (exemple : polymères) sont dispersées dans un solvant, dissoutes ou sous forme d’émulsion : eau, éther, alcool… La colle sèche parce que le solvant s’évapore, laissant alors les molécules se lier par liaisons intermoléculaires, mais sans réaction chimique. Exemple : colle blanche (polyacétate de vinyle).
Parmi ces colles, certaines sont utilisées pour un collage plus ou moins provisoire : papiers pense-bête collants, etc. Leur finalité est d’établir des liaisons assez faibles pour ne pas modifier/altérer le support, même après décollage.
→ Colles thermofusibles ou hot melt en Anglais sont solides à température ambiante. Cela concerne les polyamides, polyesters, … En les chauffant, ces colles deviennent pâteuses et aptes à coller. Elles reprennent leur aspect solide en refroidissant, figeant alors les objets collés. Elles servent par exemple à relier des livres.
Adhésifs à mise en œuvre chimique (AMOC) :
Certaines colles, dès application, sont le siège d’une réaction chimique de polymérisation, ce qui « fige » la colle. La réaction peut s’amorcer, selon les colles, de différentes manières :
• par mélange des deux réactifs au moment du collage. Exemple : la colle époxy résulte de la polymérisation entre les monomères et l’agent durcisseur (amines, etc.).
• par chauffage : colles pour métaux.
• les surfaces à coller servent de catalyseur : colles pour métaux.
• par rayonnement UV où des molécules sont brisées et amorcent alors la réaction : colles pour verres
• humidité de l’air : colle polysiloxane (colle silicone), « super-glue » …
Exemple de la « super-glue » : c’est une colle très puissante. Initialement, elle est composée d’un monomère, le cyanoacrylate, dont le nom complet est 2-cyanoacrylate de méthyle. Quand la colle est appliquée, l’humidité de l’air suffit, à travers un ion hydroxyde

Les colles à réaction chimique sont particulièrement utilisées dans les industries automobile, ferroviaire, aéronautique. Le collage présente des avantages par rapport à d’autres méthodes : pas besoin de percer les pièces à coller (pas de vis, rivets), répartition des contraintes à l’ensemble de la surface encollée, étanchéité du collage... Mais, elle présente aussi des inconvénients : irréversibilité du collage, toxicité des matières employées, ne supporte pas de hautes températures, vieillissement, sensible à l’état des surfaces encollées, sensible au pelage (arrachement des deux surfaces l’un par rapport à l’autre).
Il existe des membranes de synthèse en chimie, dans le but de ne laisser passer que certaines molécules. Applications : purification, séparation chimique, dialyse.
Les colles et adhésifs sont une méthode pour lier deux matériaux. Il en existe deux types :
• les adhésifs à mise en œuvre physique (AMOP) : évaporation d’un solvant ou thermofusibles.
• les adhésifs à mise en œuvre chimique (AMOC) : dès application, ils sont le siège d’une réaction chimique de polymérisation.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








