Les nanotubes de carbone
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
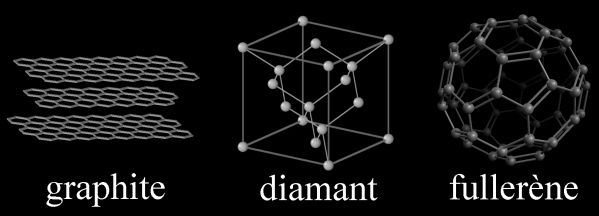
• Le graphite, ou les atomes sont disposés selon des plans parallèles entre eux. Un plan porte le nom de graphène. Le graphite est friable car les plans sont faiblement liés entre eux.
Application : mine des crayons à papier.
• Le diamant, possédant une structure plus compacte et plus dure du carbone que le graphite. La structure du diamant se retrouve d’ailleurs pour d’autres matériaux (exemple : cristal de silicium).
Après, les fullerènes sphériques comme le
Dès 1990, il fut possible de produire du
En fait, les fullerènes ne concernent pas seulement les structures sphériques, mais aussi les nanotubes de carbone, constitués de graphène replié en forme de tube. Ils ont été observés en 1991 par le physicien Japonais Sumio Iijima, en adaptant le protocole de créations des
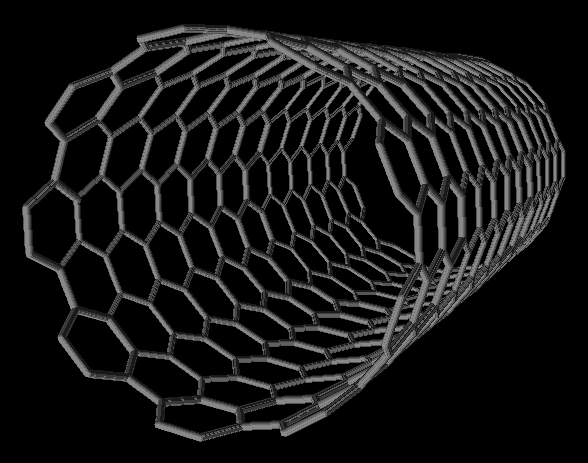
En 1993, des nanotubes monofeuillets furent obtenus par Sumio Iijima et Donald S. Bethune par deux méthodes différentes. Le diamètre typique d’un nanotube de carbone monofeuillet est voisin du nanomètre.
C’est une méthode proche de celle utilisée pour la production de
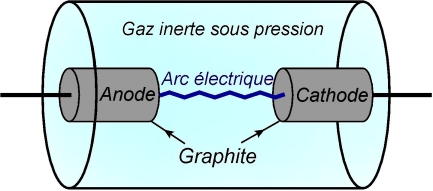
Il existe des variantes : la vaporisation des atomes de carbone peut être assurée par un LASER ou un four solaire.
Méthode du dépôt chimique en phase vapeur
Cette méthode est désignée sous le sigle CVD, de l’Anglais Chemical Vapor Deposition. C’est la méthode la plus performante actuellement pour produire des nanotubes de carbone.
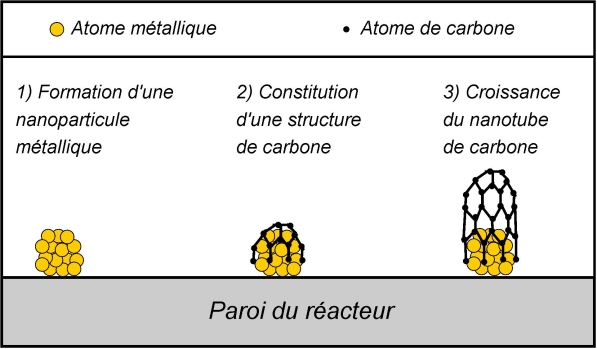
Elle consiste à injecter une source de carbone (hydrocarbure comme le toluène, benzène, cyclohaxane) avec un précurseur métallique (ferrocène
L’enceinte, aussi désignée sous le terme de réacteur, est à une température entre 600 °C et 900 °C. Sous l’effet de la chaleur, les constituants de l’aérosol se dissocient. Ainsi, des dépôts de particules métalliques ont lieu sur les parois de l’enceinte. Ces dépôts sont de taille nanométrique. Ensuite, les atomes de carbone viennent se fixer sur ces nanoparticules métalliques, afin de former une « cage ». Celle-ci va alors s’étirer au fur et à mesure de l’arrivée de nouveaux atomes de carbone, formant peu à peu des nanotubes de carbone.
Ils vont alors croître, perpendiculairement au plan de la paroi, tant que l’aérosol sera injecté. Quand il cesse, il s’est alors formé une couche de nanotubes de carbone. En projetant l’aérosol en plusieurs jets, on obtient plusieurs couches superposées.
Un avantage de la méthode est d’obtenir des nanotubes très similaires les uns des autres. Leur longueur dépend de la durée du jet d’aérosol ; elle est typiquement de l’ordre du millimètre, mais on sait en faire dont la longueur atteint plusieurs centimètres !
Il existe trois types de nanotubes, définis selon la manière dont la structure d’atomes est enroulée (hélicité) :
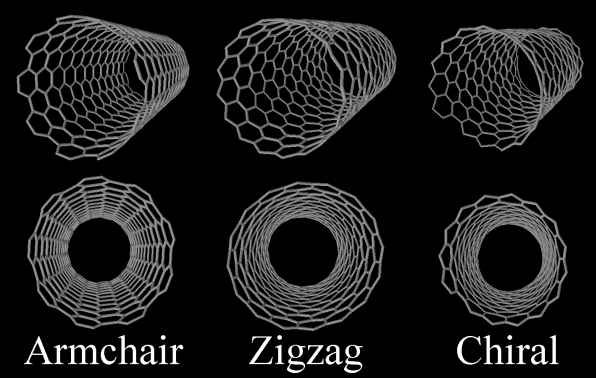
• La structure armchair (fauteuil), autrement appelée structure créneaux, de part le motif qui se dessine au niveau d’une extrémité ouverte du nanotube.
• La structure zigzag. De même, ce nom provient de l’allure du motif en bout de nanotube.
• La structure chirale. Les hexagones joints les uns aux autres dessinent une hélice qui parcourt le tube sur toute sa longueur, aux contraires des autres où on a l’impression de voir des anneaux collées les uns aux autres.
Ces trois structures sont produites simultanément lors de la fabrication des nanotubes. On ne sait pas encore en produire qu’un seul type à la fois. Notons que les nanotubes sont souvent clos à leurs extrémités, par une demi-sphère de carbone (« fullerène sphérique partagé en deux »).
Propriétés mécaniques
Les nanotubes de carbones, de part l’arrangement régulier des atomes, sont très résistants. Cela peut se comprendre par une analogie macroscopique : un tube de métal est plus résistant à la flexion qu’une barre de même masse constituée du même matériau. En étant 6 fois moins dense que l’acier, les nanotubes de carbone sont 100 fois plus résistants que lui. Leur masse volumique est voisine de 1,3 grammes par
Propriétés électriques
Comme vu dans la fiche sur les semi-conducteurs, le fait d’avoir un très grand nombre d’atomes identiques fait qu’il existe des bandes d’énergie permises pour les électrons de ces atomes. Les deux dernières bandes sont la bande de valence et la bande de conduction.
Il existe un gap d’énergie faible (
A basses températures, les nanotubes de carbone deviennent supraconducteurs.
Propriétés électrostatiques
Le paratonnerre est constitué d’une pointe métallique placée au sommet d’habitation, et reliée à la terre. Sa vocation est de canaliser l’électricité si la foudre frappe l’habitation, protégeant cette dernière. La foudre passe préférentiellement par le paratonnerre par effet de pointe : la géométrie de la pointe resserre les lignes de champ électrique à son extrémité, ce qui l’augmente localement. La pointe est alors un passage préférentiel de la décharge électrique quand la foudre frappe.
A une autre échelle, l’effet de pointe peut être utilisé par les nanotubes, car leur géométrie est aussi celle d’une pointe. La finalité est de pouvoir manipuler des électrons avec précision. On provoque une décharge électrique via un nanotube avec une différence de potentiel de 1 V.
Propriétés thermiques
Les nanotubes de carbone peuvent tolérer de fortes températures : 2000 °C dans le vide, 750 °C dans l’air. Ils sont aussi de bons conducteurs de la chaleur.
• Nouveaux matériaux incluant des nanotubes de carbone, qui seraient plus résistants et plus légers que ceux que nous connaissons actuellement.
• Nouvelles fibres textiles. A masse égale, un fil de nanotubes de carbone est plus performant qu’un fil de toile d’araignée. Les nanotubes pourraient permettre la confection de gilets pare-balles.
• Nanoélectronique. De part leur taille et leur caractère semi-conducteur, les nanotubes ouvrent la voie de la nanoélectronique. Les nanotubes de carbone pourraient alors remplacer le silicium, qui est actuellement le matériau principal en électronique.
• Ecrans plats, en utilisant l’effet de pointe des nanotubes pour injecter des électrons sur des pastilles luminescentes (sous-pixels).
• Nanopointes, pour des nano-manipulations ou nano-observations.
• Applications médicales : nanobagues (décrites fiche suivante).
• Membranes de synthèse : une couche de nanotubes pourrait constituer une membrane ne laissant passer que certaines molécules (à travers les nanotubes).
Les nanotubes de carbone constituent une technologie en plein développement. Mais, une limitation actuelle est le coût encore très élevé pour la fabrication des nanotubes, jusqu’à 1000 € par gramme pour des nanotubes monofeuillets. D’autre part, des craintes existent sur leurs effets biologiques éventuels sur l’Homme et sur l’environnement.
Actuellement, ils sont fabriqués par arc électrique ou par dépôt chimique en phase vapeur (méthode CVD).
Les propriétés des nanotubes de carbones sont particulièrement intéressantes : les nanotubes sont plus résistants que l’acier. Certains nanotubes sont semi-conducteurs, d’autres sont de bons conducteurs électriques. Ils sont supraconducteurs à basses températures, etc.
Les applications des nanotubes sont nombreuses : nouveaux matériaux plus résistants, nouveaux textiles (gilets pare-balles …), nanoélectronique à base de nanotubes, écrans plats nouvelle génération, applications médicales, etc. Par contre, ils sont actuellement chers à fabriquer.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








