Savons, tensioactifs, émulsions, mousses, cristaux liquides
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
• Expliquer ce qu’est la tension superficielle d’un liquide, comment se forme une mousse, une émulsion.
• Définir ce qu'est un cristal liquide et voir ses propriétés.
• Aborder quelques applications aux notions abordées.
Les savons sont fabriqués à partir de matières grasses, dont des triglycérides, c'est-à-dire des triesters (triple fonction ester) formés de trois longues chaines carbonées. Le savon est obtenu par une saponification du triglycéride par de la soude, selon la réaction suivante traduisant l’hydrolyse basique des fonctions ester :
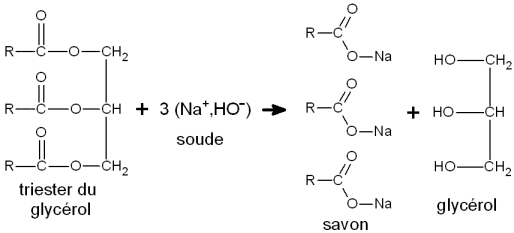
Un savon est constitué d’espèces chimiques ayant un double comportement hydrophile et hydrophobe. On parle d’espèces amphiphiles. Les molécules de savons sont de la forme
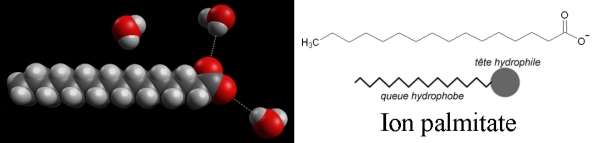
En solution aqueuse, le sodium/potassium devient un ion. Le savon est alors un carboxylate, c'est-à-dire la base conjuguée d’un acide carboxylique. Par exemple, à partir du palmitate de sodium, on obtient l’ion palmitate. La chaîne carbonée est apolaire, ce qui explique son caractère hydrophobe et lipophile (affinité avec les corps gras, par liaisons de Van der Waals). La partie
• Propriété détergente du savon
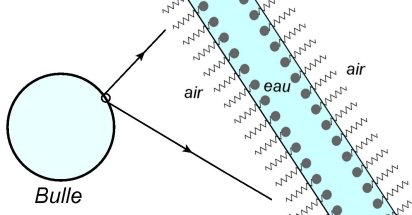
Dans une eau savonneuse, les carboxylates se disposent à la surface du liquide, de manière que les queues hydrophobes soient dirigées vers l’extérieur du liquide, et les têtes hydrophiles vers l’eau.
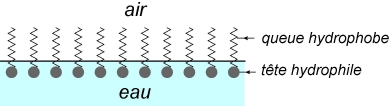
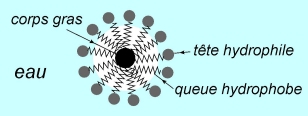
Si la concentration en carboxylates est suffisante (
La tension superficielle explique qu’un liquide comme l’eau cherche à minimiser la superficie de sa surface. Ainsi, de petites quantités d’eau forment des gouttes au lieu de s’étaler à l’infini. La tension superficielle s’exprime en Joule par mètre carré, équivalente au Newton par mètre. A 20 °C, elle vaut 72,5 mN/m pour l’eau.
• anioniques : les carboxylates (savons), sulfates
• cationiques : ions ammonium primaires
• zwitterioniques (porte des charges positives et négatives, mais la molécule reste neutre) : les phospholipides (voir fiche sur les membranes) …
• non ioniques (mais polaires) : éther d’alcools gras...
Exemple : la mayonnaise est une émulsion d’huile dans l’eau, permise par la lécithine (un phospholipide) présente dans le jaune d’œuf, qui joue le rôle de tensioactif.
Les émulsions interviennent dans l’industrie agro-alimentaire, mais aussi en cosmétique avec les crèmes hydratantes, en médecine, etc. Une émulsion est potentiellement limitée dans le temps, car les deux phases distinctes peuvent se reformer progressivement : il y a démixtion. La vitesse de rupture d’une émulsion dépend de l’efficacité des tensioactifs, de la température, de la différence de densité entre les deux liquides.
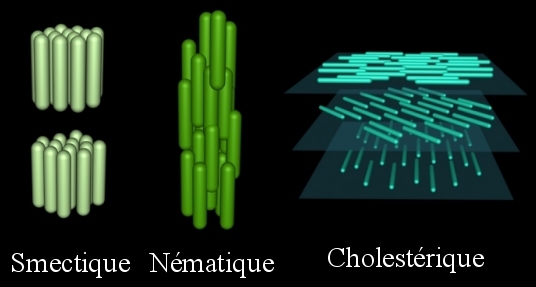
→ La phase smectique, dans laquelle les molécules sont organisées en couche. La dénomination smectique vient du scientifique Georges Friedel, s’inspirant du grec ancien smêgma (savon), car cette structure rappelle celle du savon en solution.
→ La phase nématique, où les molécules sont alignées globalement selon une même direction. Cette dénomination vient aussi de Georges Friedel, du grec ancien nêma (fil).
→ La phase cholestérique (ou nématique chirale), où les molécules sont selon des plans parallèles entre eux. Au sein d’un même plan les molécules présentent une même orientation. D’un plan consécutif à l’autre, l’orientation change selon un angle donné. La structure est ainsi comparée à une hélice, dont le pas est la distance entre deux plans de même orientation. « Cholestérique » vient du fait que les esters formés à partir du cholestérol sont des cristaux liquides présentant cette structure. Exemple : benzoate de cholestéryle.
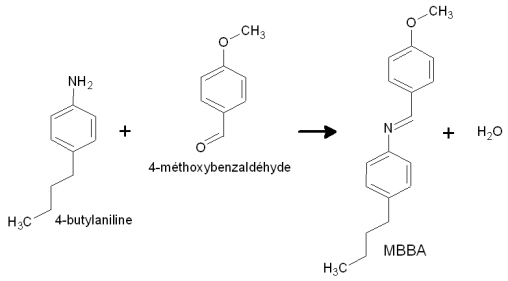
Historiquement, cette synthèse a été proposée en 1969 par Kelker et Scheurle. Ce fut le premier cristal liquide synthétisé qui soit en phase nématique à température ambiante. En effet, le MBBA est solide cristallin en dessous de 20 °C, est un liquide nématique opaque entre 20 °C et 38,1 °C, et liquide transparent isotrope au-delà…
• Une vitre à transparence variable comporte des gouttelettes de cristaux liquides, entre deux électrodes transparentes. Au repos, les cristaux liquides sont orientés selon des directions quelconques, ce qui diffuse la lumière, rendant la vitre translucide. Quand une tension est appliquée, les cristaux s’orientent perpendiculairement à la vitre, minimisant leur interaction avec la lumière : la vitre devient transparente.
• L’afficheur à cristaux liquides 7 segments fait intervenir la notion de polarisation de la lumière, hors programme. Au repos, l’arrangement des cristaux liquides ("nématiques twistés") permet à la lumière de passer à travers le dispositif de polarisation : un segment de l’afficheur est transparent. Quand une tension est appliquée, la lumière ne passe pas : le segment apparaît noir.

• L’écran à cristaux liquides ou LCD (Liquid Crystal Display) comporte des pixels divisés en trois sous-pixels rouge, vert et bleu. Chaque sous-pixel fonctionne comme un segment de l’afficheur, sauf qu’il peut moduler l’intensité de la lumière transmise. Celle-ci est fournie par un dispositif de rétroéclairage (lumière blanche). Les couleurs rouge, vert, bleu des sous-pixels sont obtenues par des filtres colorés.
→ Les cristaux liquides cholestériques possèdent des propriétés optiques particulières. En effet, les plans de même orientation sont assimilés à des « miroirs parallèles » satisfaisant la loi de Bragg (décrivant la diffraction de rayons X par un cristal). Elle explique que seules les longueurs d’onde
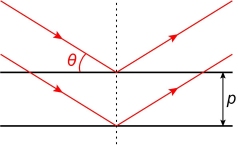
k est un nombre entier, p est le pas de l’hélice (en m),
Les cristaux liquides cholestériques sont présents dans les billets de banque, dans la partie qui change de couleur selon l’angle d’observation. C’est un dispositif anti-copie du billet.
p diminue quand la température augmente, donc la couleur diffusée est modifiée. On parle de cristaux liquides thermochromiques. Cela permet de les utiliser comme thermomètre :
• comme ceux utilisés sur les parois des aquariums domestiques.
• pour des applications médicales, pour réaliser des thermographies en déposant le matériau sur la peau du patient.
• pour des testeurs de pile : le passage du courant électrique échauffe localement le matériau, ce qui provoque l’apparition d’une coloration (jaune).
• Les savons ont des propriétés détergentes grâce à la structure amphiphile (partie hydrophile + partie hydrophobe) des carboxylates.
• Les amphiphiles sont aussi des tensioactifs (abaissent la tension superficielle d’un fluide comme l’eau) permettant la formation de mousses (eau + air) ou d’émulsions entre deux liquides non miscibles.
• Les cristaux liquides nématiques ont des propriétés optiques qui peuvent être modifiées par l’application d’un champ électrique (par orientation de ces molécules). Exemples : afficheur à cristaux liquides, écran LCD, vitres à transparence modifiable.
• Les cristaux liquides cholestériques peuvent présenter une coloration, qui dépend notamment de la température.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








