Mise en évidence des facteurs cinétiques
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
• Voir ainsi comment il est possible d’accélérer une réaction de ce type.
• Pour chaque paramètre, donner des arguments physiques permettant d’expliquer les résultats obtenus.
• Pour le premier bécher, c1= 0,20 mol.L-1 ;
• Pour le deuxième bécher, c2= 0,40 mol.L-1 ;
• Pour le troisième bécher c3= 0,60 mol.L-1.
Mais l'évolution de la couleur des solutions ne se fait pas au même rythme. La solution contenue dans le troisième bécher est la première à se colorer en brun, suivie par celle du deuxième bécher, elle-même suivie par celle contenue du premier bécher.
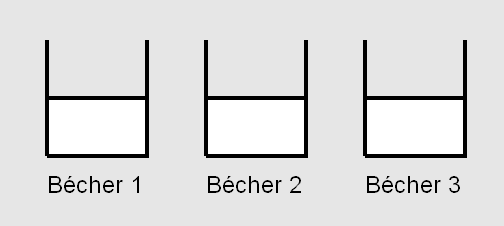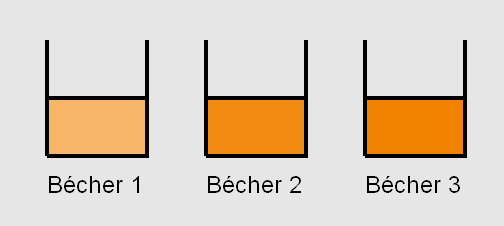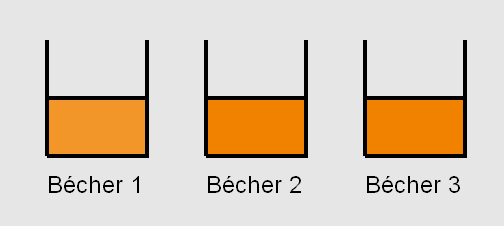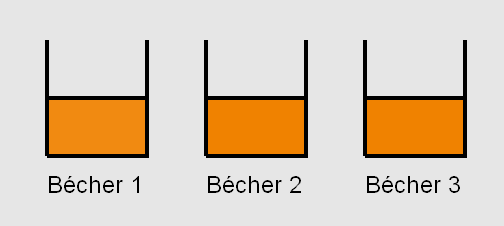
Le diiode est de couleur brune en solution (jaune quand il est dilué). Ainsi, la formation de diiode par la réaction explique l’apparition de la coloration jaune puis brune du milieu réactionnel, dans chaque bécher.
D’un bécher à l’autre, on pourrait vérifier à l’aide d’un tableau d’avancement que H2O2 est toujours le réactif limitant. Cela signifie que la concentration finale de diiode formé est la même pour les trois béchers. La seule différence est la concentration initiale en ions I–. À travers cette expérience, on note donc que plus la concentration en I– est forte, plus la réaction évolue rapidement vers la coloration brune, c'est-à-dire vers son état final.
On dit que la concentration des réactifs est un facteur cinétique.
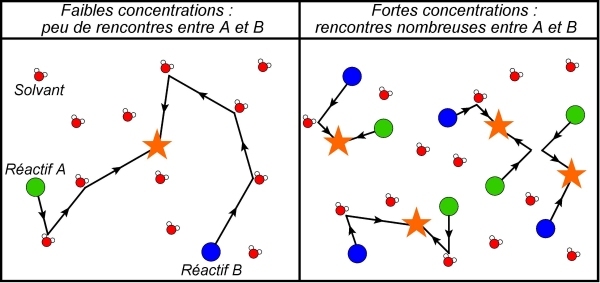
→ Plus A et B sont dilués, plus le nombre de rencontres entre A et B va être faible : la réaction sera donc très lente.
→ À l’inverse, plus ces deux réactifs sont concentrés, plus on peut trouver de A et de B dans un volume donné, et donc plus le nombre de rencontres par unité de temps entre A et B va augmenter, ce qui va induire que la réaction va se produire plus vite.
• Plaçons le premier tube dans un bain-marie d'eau glacée (
• Plaçons le deuxième tube dans un bain-marie d'eau tiède (
• Plaçons le troisième tube dans un bain-marie d'eau chaude (
Dans le deuxième tube, une légère coloration orange apparaît au bout de plusieurs minutes.
Dans le troisième tube, un précipité rouge brique apparaît au bout de quelques secondes.
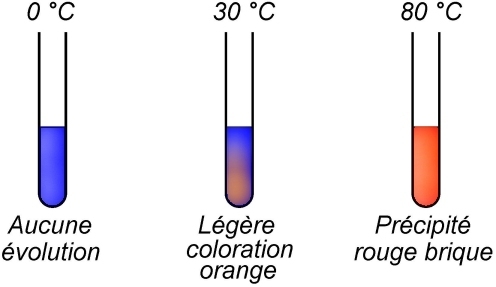
Les résultats observés nous amènent à conclure qu’il n’y a pas réaction dans le premier tube, même si les réactifs sont présents. La réaction est très lente dans le deuxième tube et plus rapide dans le troisième tube. La température étant le seul paramètre modifié d’un tube à l’autre, elle est donc responsable de ces différentes évolutions.
• Le principe d’un réfrigérateur est de refroidir suffisamment un aliment pour stopper ou du moins ralentir l’action des bactéries (assimilée à des réactions chimiques lentes), pour qu’il reste consommable.
• En particulier en biochimie, une température trop forte peut dénaturer les réactifs, au lieu d’accélérer la réaction.
• En Travaux Pratiques, on peut chauffer un milieu réactionnel (chauffage à reflux, chauffage au bain marie), afin d’accélérer une réaction de synthèse.
• Toujours en Travaux Pratiques, pour stopper une réaction lente, on effectue une « trempe », qui consiste à verser de l’eau froide, afin de refroidir et diluer les réactifs.
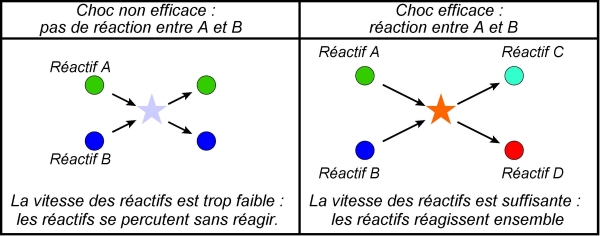
→ Si la température est très faible, la vitesse moyenne des particules est basse, et ces dernières ne peuvent donc pas se percuter de manière efficace : la réaction est bloquée.
→ Quand la température augmente, la vitesse moyenne des particules croît, et donc le nombre de chocs efficaces par unité de temps augmente : la réaction est ainsi plus rapide.
On renouvelle l’opération avec un morceau de fer identique B, mais sans appliquer le vernis : la couche polie est exposée à l’air libre.
On considère aussi de la limaille (poudre) de fer C, de masse totale identique à celle de A ou B.
On laisse ces trois échantillons plusieurs jours dans un milieu fortement humide.
La surface du morceau de fer B s’est recouverte d’une légère couche d’oxydation (la « rouille »). En attendant suffisamment longtemps (plusieurs années), l’oxydation se propage dans le matériau de plus en plus profondément.
La limaille de fer C a été entièrement oxydée. La quantité de « rouille » formée est supérieure à celle observée avec B.
La réaction ne peut avoir lieu que si les réactifs sont en contact. Au niveau microscopique, une réaction chimique résulte de la rencontre entre les entités (atomes/molécules, ...) constituant les réactifs. Si les réactifs ne peuvent pas se rencontrer, la réaction ne peut pas se produire. C’est ce qu’il s’est passé avec le morceau de fer A : la couche de verni a empêché le dioxygène et l’eau d’atteindre les atomes de fer, ce qui a protégé A de l’oxydation.
Avec B, seule la zone exposée à l’air et à l’humidité a subi l’oxydation. La réaction a lieu au niveau de la surface de contact entre le fer et les autres réactifs. Par contre, comme l’oxyde de fer est un matériau poreux, la couche d’oxydation ne protège pas les atomes de fer non oxydées se trouvant juste en dessous : le dioxygène et l’eau peuvent s’infiltrer de plus en plus profondément, jusqu’à l’oxydation complète du matériau.
Avec la limaille C, le fer a été complètement oxydé car la surface de contact entre le fer et les autres réactifs (dioxygène et eau) est plus forte qu’avec B, ce qui permet d’oxyder plus de fer pendant une même durée. La réaction est ainsi plus rapide.
→ L’éclairement peut constituer un facteur cinétique. Par exemple avec la synthèse chlorophyllienne, il est même indispensable pour que la réaction se produise.
→ La nature du solvant peut également être importante. En effet, un solvant ayant par exemple de fortes affinités avec un des réactifs (si les deux sont polaires, par exemple) pourrait dans certains cas gêner la rencontre entre réactifs, et ainsi ralentir la réaction.
→ L’agitation du milieu réactionnel favorise le mélange entre les différents réactifs, et favorise donc leur rencontre, ce qui peut accélérer une réaction lente.
La concentration des réactifs (pour réactifs liquides ou gazeux) et la température du système sont les facteurs cinétiques principaux. D’une manière générale, plus la concentration des réactifs est élevée et/ou plus la température est forte, plus la réaction est rapide.
Il existe d’autres facteurs cinétiques, comme la surface de contact des réactifs (pour des réactifs solides), l’éclairement, la nature du solvant, ...

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








