Le réactif limitant et l'avancement maximal
- Fiche de cours
-
Quiz et exercices
1
- Vidéos et podcasts
En classe de seconde, on considère que les
réactions étudiées s'arrêtent
lorsqu'au moins un réactif est consommé
totalement. Ce réactif est appelé
réactif
limitant. Le ou les autres
réactifs sont donc en excès.
Il est parfois simple de déterminer le
réactif limitant sans faire de calcul.
Par exemple :
Lors de la combustion du méthane à
l'air libre dans une gazinière :
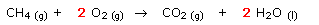
Comme la réaction se fait à l'air libre, le dioxygène est en quantité infinie. Cette réaction s'arrêtera donc lorsque tout le méthane sera consommé : le méthane est donc le réactif limitant, le dioxygène de l'air étant le réactif en excès.
On définit l'avancement maximal (noté xmax) comme l'avancement dans l'état final du système chimique, c'est-à-dire lorsqu'on ne constate plus d'évolution du système chimique.
On peut également dire que l'avancement
maximal est directement lié à la
consommation totale d'un des réactifs (ce
qui signifie que xmax est une grandeur
proportionnelle à la quantité de
matière initiale du réactif
limitant !).
Lorsqu'on calcule l'avancement maximal, on
détermine le réactif limitant et si on
connaît le réactif limitant, on
connaît l'avancement maximal.
Reprenons l'exemple choisi en considérant 5 moles
de méthane dans un espace confiné où
l'on trouve 20 moles de dioxygène. A chaque
instant, les quantités de matière
présentes sont :
nt(CH4) = 5 - x
nt(O2) = 20 - 2x
Dans l'état final, on a donc deux choix
possibles :
Si le carbone est réactif limitant, alors
nf(CH4) = 0 donc 5 -
xmax = 0.
Ceci conduit à xmax = 5 mol ce qui
signifie que dans l'état final :
nf(C)=0 mol et nf(O2)=
20 - 2 x 5 = 10 mol.
Si le dioxygène est le réactif limitant
alors nf(O2) = 0 donc 20 -
2xmax = 0.
Ceci conduit à xmax= 10 mol ce qui
signifie que dans l'état
final :
nt(CH4) = 5 - 2 x 10 = - 15 mol et
nt(O2) = 0.
Une quantité de matière étant
nécessairement positive, on considère que
cette solution est absurde.

En conclusion, on peut obtenir l'avancement maximal en choisissant comme réactif limitant celui qui conduit à une valeur d'avancement maximal la plus petite possible !
L'avancement maximal correspond à la quantité de matière introduite de ce réactif divisée par le nombre stoechiométrique qui lui est attribué par l'équation chimique.
Teste dès maintenant tes nouvelles connaissances dans notre quiz
Vous avez obtenu75%de bonnes réponses !
Reçois l’intégralité des bonnes réponses ainsi que les rappels de cours associés

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








