Formulaire Chimie Tle
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Savoir appliquer des formules données.
- Connaitre l’unité des principales grandeurs dans le système international.
Une espèce chimique, qu’elle soit liquide, solide ou gazeuse, peut être caractérisée par différentes grandeurs caractéristiques.
|
|
avec :
|
La masse volumique peut aussi s’exprimer en g·L−1, g·mL−1, kg·cm−3, etc.
Pour passer d’une unité à l’autre, on utilise la conversion 1 m3 = 103 L.
|
|
avec :
|
ρeau = 1 kg·L–1 = 10–3 kg·m–3 = 103 g·L–1.
Pour une espèce solide ou liquide.
|
|
avec :
|
Pour une espèce gazeuse.
| P × V = n × R × T |
avec :
|
- La pression peut être exprimée en bar. Pour la convertir en pascal, il faut utiliser la relation 1 bar = 105 Pa.
- La température peut être exprimée en degré Celsius (°C). Pour la convertir en Kelvin, il faut utiliser la relation 0 °C = 273 K.
|
|
avec :
|
|
|
avec :
|
Pour un ion X solvaté en solution, sa concentration s’exprime par
|
|
avec :
|
|
|
avec :
|
|
|
avec :
|
|
|
avec :
|
- Le titre massique est toujours compris entre 0 et 1.
- En multipliant le titre massique par 100, on obtient le pourcentage massique, qui est souvent donné dans les énoncés.
|
|
avec :
|
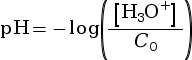
|
avec :
|
| σ = k × C |
avec :
|
|
A = k × C |
avec :
|
Une réaction chimique est caractérisée par son rendement.
|
|
avec :
|
|
|
avec :
|
|
|
avec :
|
| vRéactif = kR × [R] |
avec :
|
| vProduit = kP × [P] |
avec :
|

|
|
Au cours d’une réaction nucléaire, deux lois de conservation (appelées loi de Soddy) doivent être respectées.
|
| Type de radioactivité | Particule émise | Symbole de la particule | Équation de désintégration radioactive |
|
Béta moins (β–) |
Électron |

|
|
|
Béta plus (β+) |
Positon |

|
|
|
Alpha (α) |
Noyau d’hélium 4 |
|
|
| ∆N(t) = –λ × N(t) × ∆t |
avec :
|
Soit une réaction d’équation aA + bB = cC + dD
|
|
avec :
|
À l’équilibre, le quotient de la réaction Qr équivaut à la constante d’équilibre Ke :
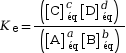
|
|
avec :
|
- Les deux avancements xf et xmax doivent être exprimés dans la même unité.
- Si 1 > τ > 0, la réaction est non totale et si τ = 1, la réaction est totale.
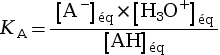
|
avec :
|
|
|
avec :
|
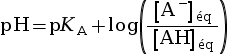
|
avec :
|
La pile, tout comme l’électrolyseur, constitue un circuit électrique dans lequel circule un courant I.
(en fonction de la capacité électrique)
|
|
avec :
|
et la quantité de matière des électrons
|
|
avec :
|
|
Q = N × e Q = n(e–) × F |
avec :
|

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !









