La réaction chimique du fer avec l'acide chlorhydrique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Mettre en évidence la présence des ions ferreux, chlorure et le dihydrogène.
- Caractériser la réaction chimique entre le fer et l'acide chlorhydrique.
- Écrire le bilan de la réaction.
Niveau préconisé : 3e
- Le fer réagit avec les acides en général. Pour cette raison, les emballages alimentaires qui en contiennent sont protégés par du vernis ou de la peinture.
- Cette réaction avec l'acide chlorhydrique
conduit à la formation de dihydrogène et
d'une solution de chlorure ferreux.
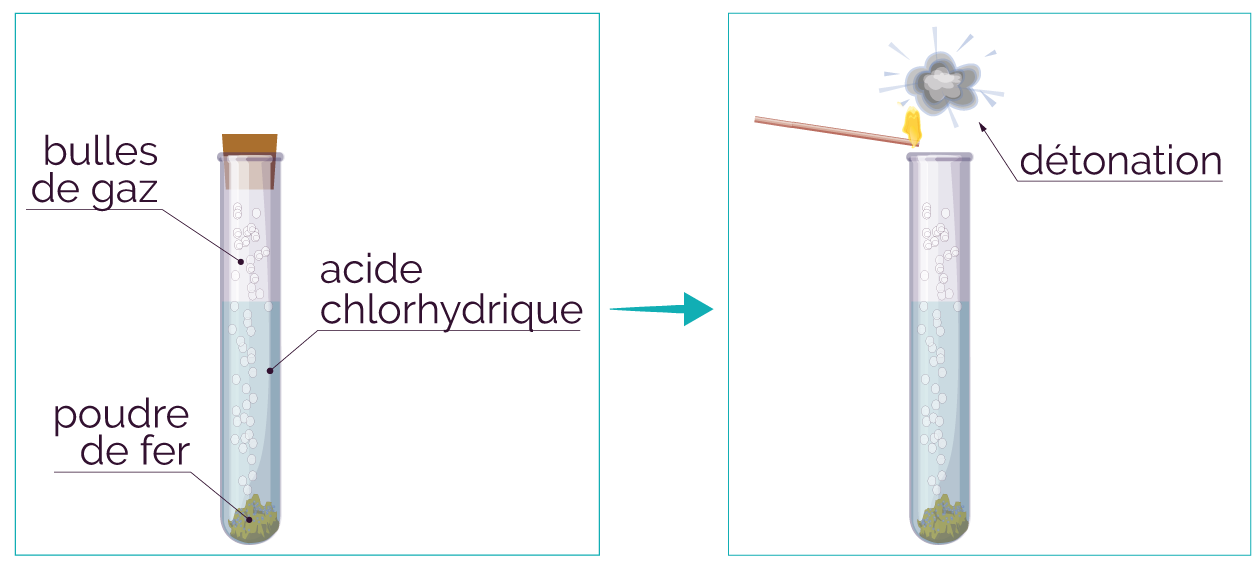
- Si on approche une allumette enflammée à l'extrémité d'un tube à essai et que l'on entend une petite détonation, cela prouve la présence d'un gaz qui est le dihydrogène (H2).
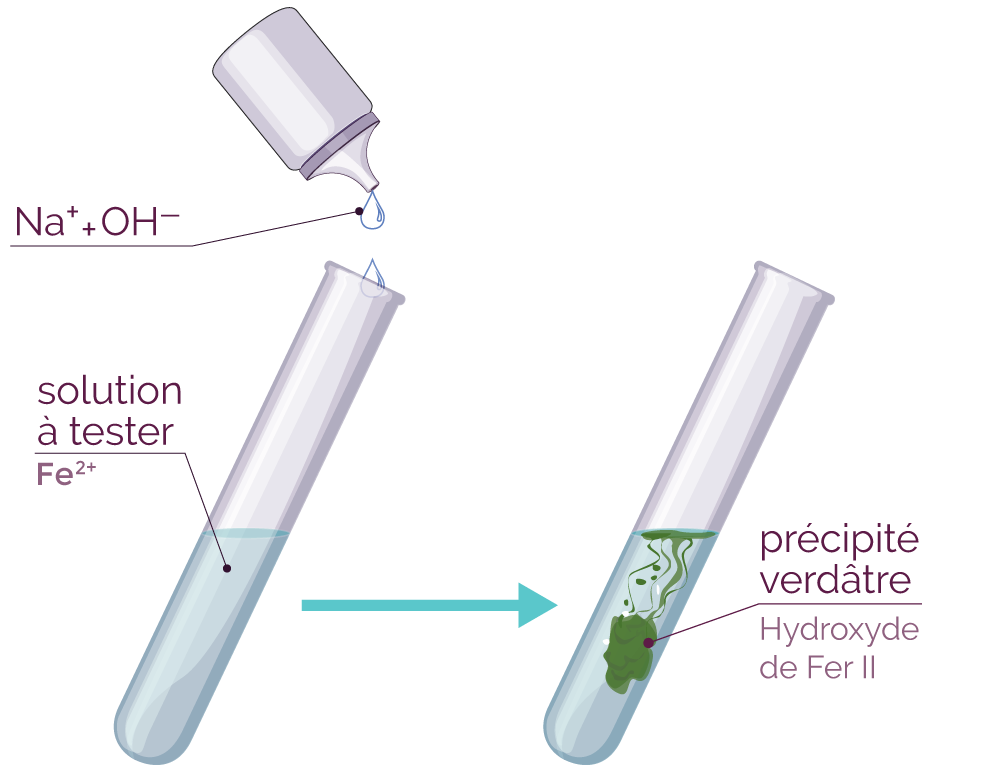
- Si on ajoute quelques gouttes de soude dans le tube à essai et que l'on observe la formation d'un précipité vert, cela prouve la présence d'ions ferreux (ou ions fer II).
- La réaction de l'acide chlorhydrique avec le fer
est une réaction chimique.
Le bilan de la réaction s'écrit :fer + acide chlorhydrique → dihydrogène + solution de chlorure de fer II - Attention : le dihydrogène et le dioxygène de l'air forment un mélange détonnant.
- Le caractère acide, basique, neutre d'une solution
- Le lien entre le pH et le caractère acide, basique ou neutre d'une solution
- L'équation d'une réaction chimique
Si un expérimentateur verse de l'acide chlorhydrique sur une plaque de fer, il observe une auréole au niveau de la zone du contact. L'acide attaque la surface métallique.
Si l'acide chlorhydrique (de formule (H+ + Cl–)) est mis au contact de fer en poudre (dans un tube à essai), la réaction est plus importante encore.
Le fer et l'acide chlorhydrique sont appelés les réactifs, ils agissent.
La réaction entre l'acide chlorhydrique et le fer engendre un dégagement gazeux. En fin de réaction, il n'y a plus de dégagement gazeux et la quantité de poudre de fer a diminué.
Au cours de la réaction, le fer a réagi. Il a « disparu ». En réalité, il s'est transformé !
Le gaz formé est testé avec une allumette. Il y a une petite détonation. C'est du dihydrogène, de formule H2. Ce gaz est l'un des produits formés pendant la réaction.
 Test caractéristique
du dihydrogène
Test caractéristique
du dihydrogène
Le dihydrogène gazeux mélangé à l'air constitue un mélange détonnant violent !
On recherche ensuite la présence des ions dans la solution finale :
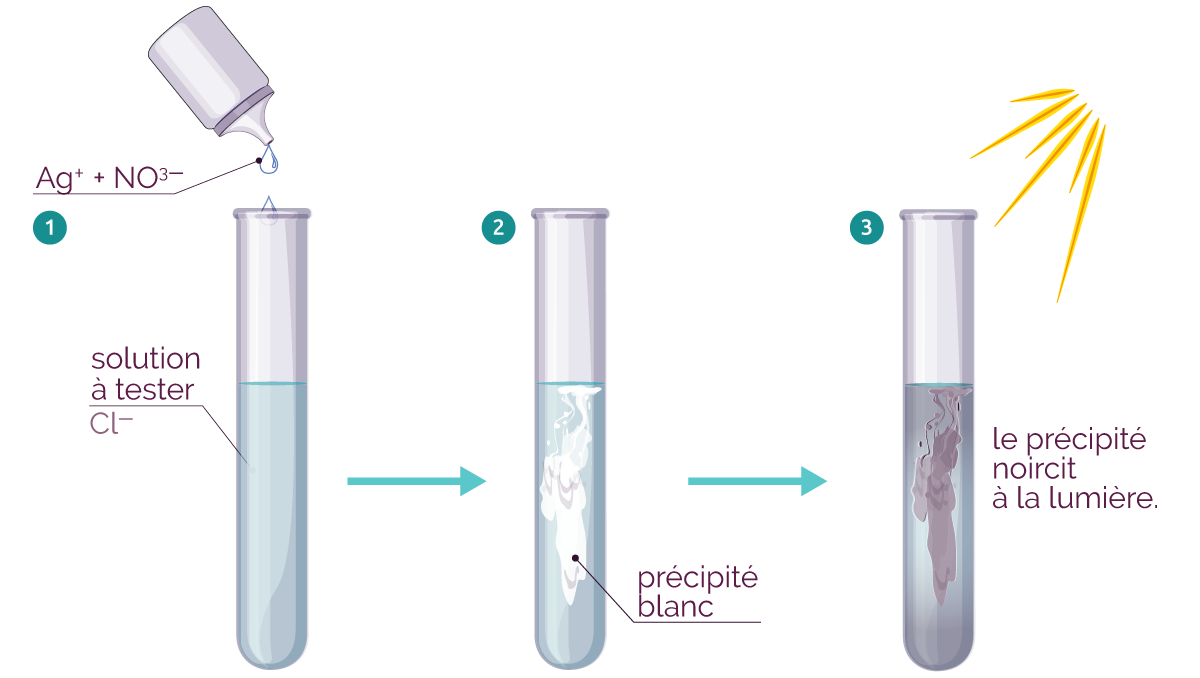
- Test au nitrate d'argent (Ag+ +
NO3–).
 Test
caractéristique d'ions chlorure
Test
caractéristique d'ions chlorure
- Test à la soude (Na+ + OH–).
 Test
caractéristique d'ions fer II
Test
caractéristique d'ions fer II
- Le test au nitrate d'argent est positif
(formation d'un précipité blanc qui
noircit à la lumière) : il y a donc
des ions chlorure dans la solution finale.
Remarque
Le test au nitrate d'argent prouve que les ions chlorure sont encore présents dans la solution finale. Ils n'ont pas réagi. On dit qu'ils sont spectateurs. - Le test à la soude est positif (formation d'un précipité vert) : il y a donc des ions ferreux (ou ions fer II) dans la solution finale. Ils proviennent des atomes de fer qui se sont transformés.
La solution finale contient donc des ions chlorure et des ions fer II. C'est une solution de chlorure de fer II. Cette solution est le deuxième produit de la réaction.
- les réactifs de cette réaction sont le fer et les ions hydrogène ;
- les produits formés sont le dihydrogène et la solution de chlorure de fer II.
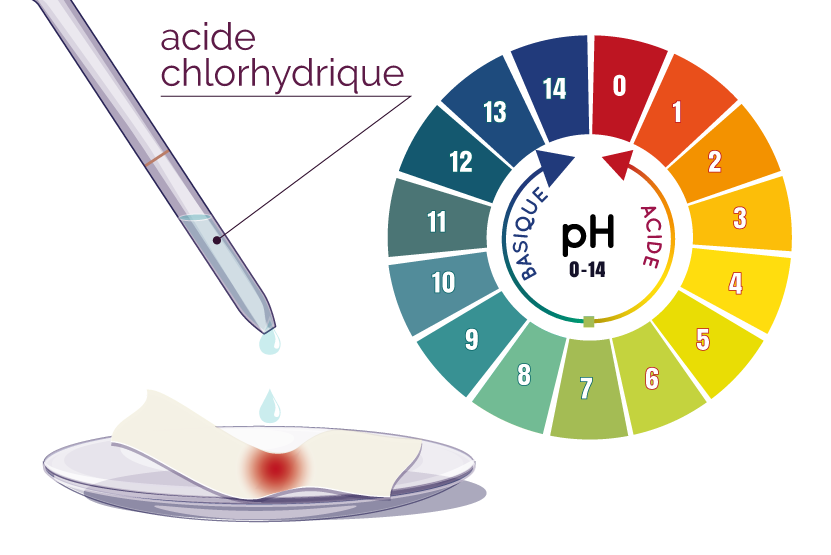
L’acide chlorhydrique est une espèce chimique acide.
On peut mesurer la valeur de son acidité en mesurant son pH. Une goutte de l’acide est versée sur du papier pH. La couleur du papier donne la valeur du pH. L’acide chlorhydrique, comme tout acide, contient donc des ions hydrogène (cation) de formule H+.
 Mesure du pH
Mesure du pH
Lorsque la réaction est terminée, c'est-à-dire lorsque le dégagement n’a plus lieu, on peut analyser le contenu du tube à essai.
La mesure du pH montre une valeur très supérieure au pH initial de l’acide. Les ions hydrogène ont alors été transformés en dihydrogène.
Si tout l’acide a réagi, le pH de la solution finale devra être égal à 7 (neutre).
La réaction entre l'acide chlorhydrique et le fer a abouti à la réorganisation des éléments chimiques de départ (les réactifs). C'est donc une transformation chimique entre un acide et un métal.
On peut alors écrire le bilan de la réaction :
fer + acide chlorhydrique → dihydrogène + solution de chlorure de fer II
L'équation de la réaction du fer et l'acide chlorhydrique est la suivante :
Fe(s) + 2H+(aq) → Fe2+(aq) + H2(g)
On dit que le fer a subi une corrosion.
Comme toute réaction chimique, on peut remarquer que tous les atomes qui étaient présents dans les réactifs ont été conservés dans les produits de la réaction.
On vérifie alors que :
Phrase célèbre d'Antoine Laurent de Lavoisier, un chimiste français du 18e siècle.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








