Interaction lumière-matière : introduction à la mécanique quantique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
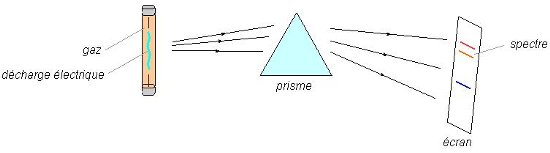
Le spectre obtenu est nommé spectre d’émission du gaz étudié. Il est différent d’un gaz à l’autre.
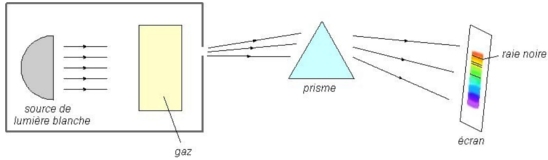
Le spectre obtenu est le spectre d’absorption du gaz. Comme pour le spectre d’émission, il change d’un gaz à l’autre.
• le modèle ondulatoire (la lumière est une onde)
• le modèle corpusculaire (la lumière est un faisceau de particules).
En fait, la lumière est à la fois une onde et un faisceau de particules.
Dans le modèle corpusculaire, les particules de lumière sont nommées photons. Chaque photon a une énergie qui est donnée par la relation de Planck :
L’énergie E du photon est en Joule. Le terme h est la constante de Planck avec
Dans le vide,
Afin de représenter les niveaux d’énergie d’un atome, on fait appel à des diagrammes d’énergies. Ci-après le diagramme simplifié d’un atome de lithium :
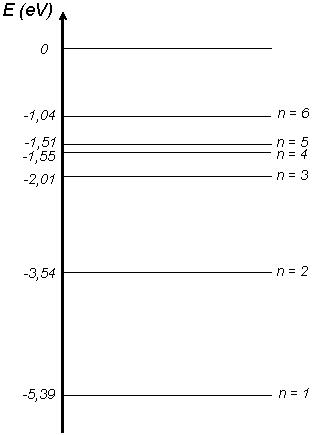
L’état le plus bas est appelé état fondamental ; les autres sont des états excités. Les états d’énergie sont conventionnellement d’énergies négatives, et repérés par des numéros :
Dans la pratique, les énergies des différents niveaux sont exprimées en électron-Volt, qui est une unité plus adaptée que le Joule à l’échelle de l’atome. Le passage d’une unité à l’autre s’obtient par la relation :
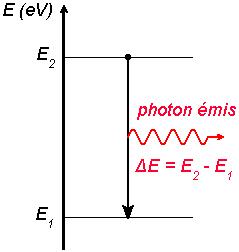
Dans l’exemple du schéma, le photon résultant de la transition
Dans le croquis ci-dessous, le photon est absorbé parce qu’il a exactement l’énergie requise
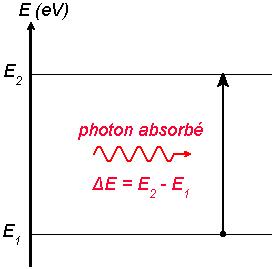
Pour le spectre d’absorption, l’exposition du gaz à de la lumière blanche fait que les photons incidents vont présenter toutes les longueurs d’onde du visible. Seuls ceux qui pourront provoquer une transition vers un état plus élevé seront absorbés. Ils seront certes réémis par désexcitation, mais dans des directions aléatoires autres que la direction incidente. Ceci explique le spectre d’absorption trouvé, constitué de raies noires.
Avec
A l’échelle de l’atome, l’électron-volt est une unité d’énergie plus adaptée que le Joule.
Les atomes ne peuvent occuper que certains niveaux d’énergie. Cette propriété fait qu’un atome dans un état d’énergie

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








