Détermination expérimentale de l'énergie mise en jeu lors d'un changement d'état
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
• d'un bécher de 250 mL ;
• d'un thermomètre précis au dixième de °C ;
• d'une baguette de verre ;
• de polystyrène compensé pour calorifuger le bécher ;
• d'une balance ;
• d'une éprouvette graduée de 200 mL.
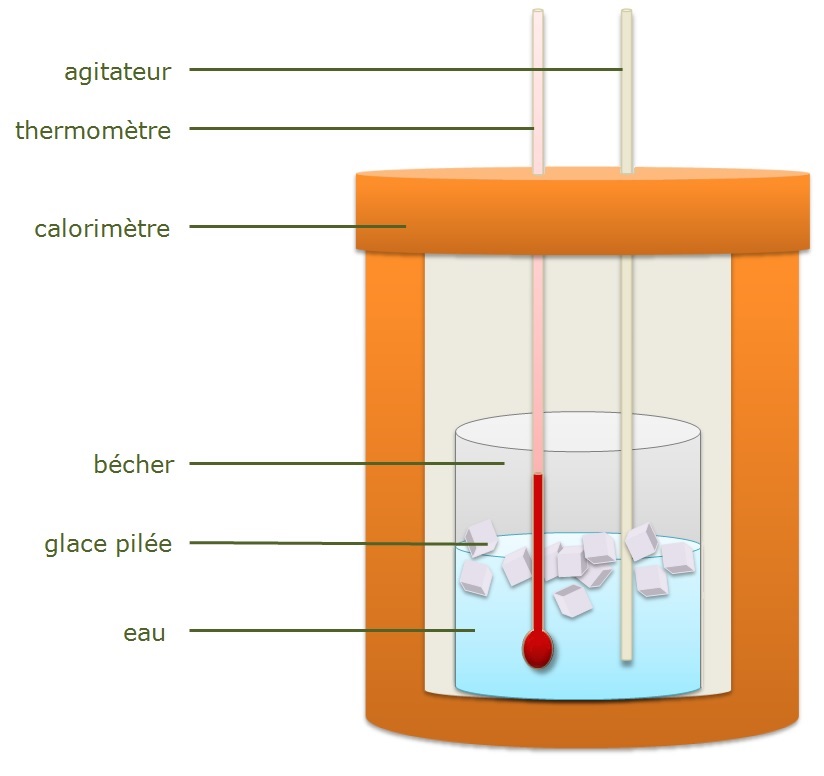
• Pour faire augmenter de 1 °C un gramme d'eau, il faut fournir une chaleur de 4,18 J.
• On note Qsystème la chaleur échangée par le système au cours de l'expérience (on note ainsi Qeau, Qbécher...)
L'ensemble {bécher+glaçon+eau} est calorifugé, ce qui signifie qu'il n'échange aucune chaleur avec le milieu extérieur :
• faire fondre le glaçon à la température constante de 0 °C en lui cédant de l'énergie : Q1 = nglaçon × Qfusion ;
• « chauffer » l'eau fondue (10 g) de 0 °C à 15,3 °C en lui cédant de l'énergie : Q2 = + 10 × 15,3 × 4,18 = 640 J ;
• Qglaçon = Q1 + Q2 = nglaçon × Qfusion + Q2 d'où :
Application numérique :
L'énergie dégagée par la fusion de la glace est donc de
• On place ensuite un thermomètre et un thermoplongeur dans l'eau et on calorifuge le bécher avec du polystyrène compensé. Ainsi on pourra supposer que toute la chaleur Q dissipée par la résistance ne sert qu'à chauffer l'eau.
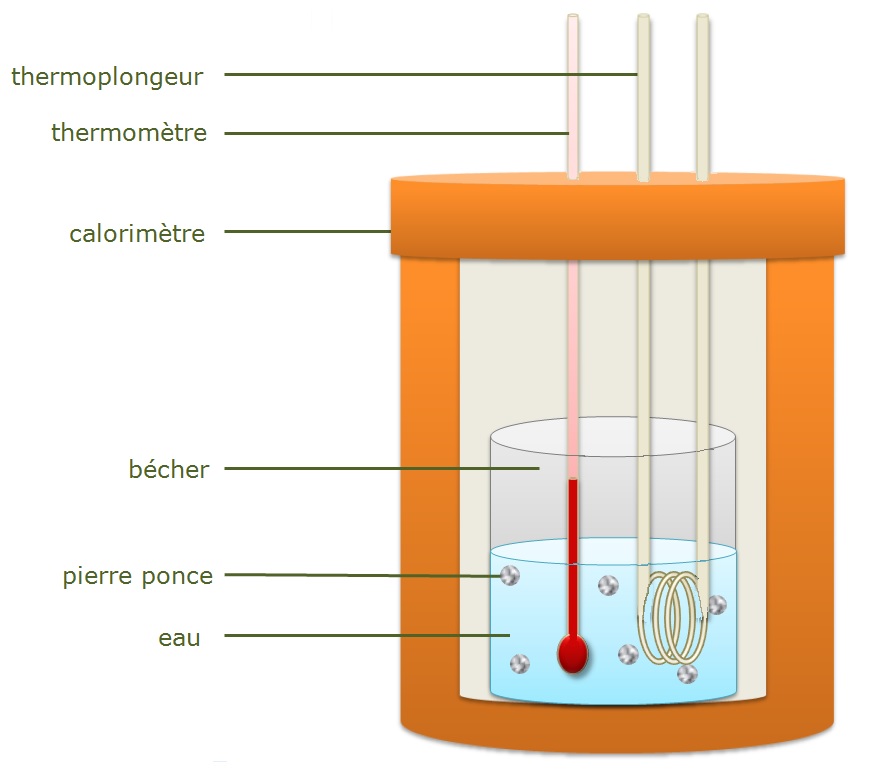
• On ferme l'interrupteur. L'eau s'échauffe et commence à bouillir. Au bout de quelques minutes, l'eau ne se condense plus sur les parois du bécher. On enclenche alors un chronomètre et l'on note la tension U aux bornes du thermoplongeur
• Le thermomètre indique une température stable de
• la durée
• On ôte le polystyrène autour du bécher et l'on attend qu'il refroidisse pour estimer la masse d'eau restante dans le bécher soit
La chaleur reçue par
d'où
La chaleur molaire de vaporisation de l'eau est donc d'environ
• en mélangeant le corps pur à température ambiante avec un autre corps ne changeant pas d'état, dans un récipient calorifugé et en attendant que le premier corps change d'état « naturellement » ;
• en introduisant une résistance chauffante produisant le changement d'état et en calculant la chaleur dissipée par l'effet Joule correspondante.
Ces méthodes nécessitent un dispositif expérimental minimisant les fuites thermiques, ce qui est difficile à mettre parfaitement en œuvre, et donc, malheureusement, les imprécisions sur la mesure des grandeurs de changement d'état sont importantes.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








