Applications des techniques d'extraction, séparation et identification des matériaux
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
• Élaborer et mettre en œuvre un protocole d’extraction à partir d’informations sur les propriétés physiques des espèces chimiques recherchées.
• Utiliser une ampoule à décanter, un dispositif à filtration, un appareil de chauffage dans les conditions de sécurité.
Dans le domaine du sport, la chimie est continuellement présente, que ce soit dans l’élaboration de matériaux plus performants, dans l’extraction des espèces naturelles ou synthétisées, dans la recherche des produits dopants, etc. Plusieurs techniques sont alors utilisées pour extraire, séparer et identifier des espèces chimiques.
Plusieurs méthodes simples existent :
• Pressage : on exerce une pression pour faire sortir un produit ;
• Décoction : on place dans de l’eau froide des végétaux et on les porte à ébullition. On récupère alors les espèces par évaporation ;
• Infusion : on trempe des végétaux dans de l'eau bouillante ;
• Macération : on fait séjourner à froid une substance dans un liquide ;
• Enfleurage : on dispose sur de la graisse des végétaux et on recueille sur celle-ci des arômes ;
• Décantation solide/liquide ou filtration :
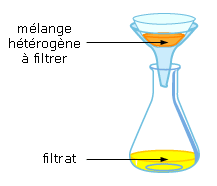
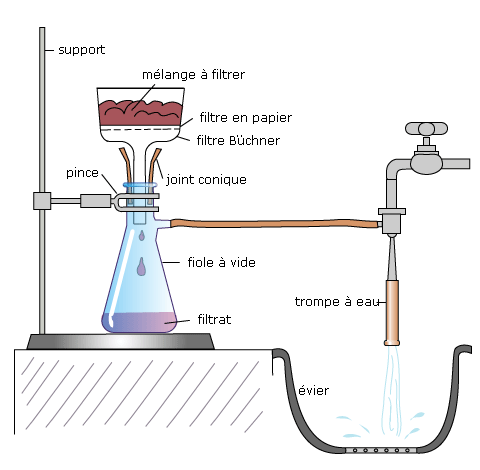
• Filtration sous vide :
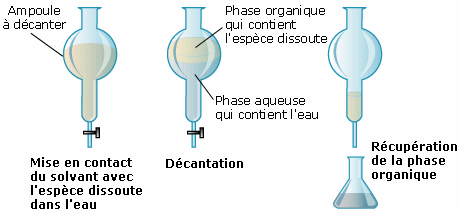
Cette méthode se réalise dans une ampoule à décanter.
Le choix du solvant dépend de l’espèce chimique recherchée. L’espèce chimique à extraire doit être plus soluble dans le solvant que dans l'eau et le solvant ne doit pas être miscible à l'eau.
Le solvant étant volatil, il est possible de l'évaporer facilement et ainsi de récupérer l'espèce chimique.
Rappel : Deux liquides qui ne se mélangent pas sont dits non-miscibles. Ils forment une phase supérieure et une phase inférieure. La phase supérieure est constituée par le liquide le moins dense, celui qui constitue la phase inférieure est le liquide plus dense.
Extraction du diiode dissous dans une solution antiseptique.
Extraction des huiles essentielles.
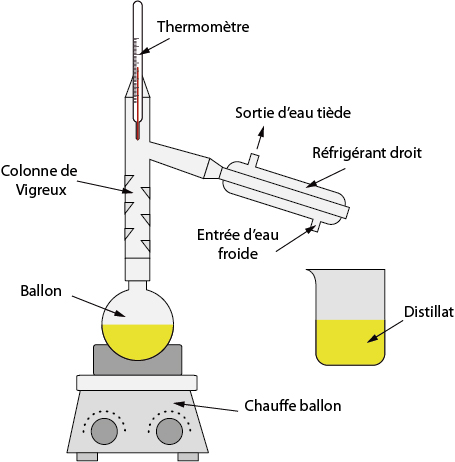
Principe :
• Le mélange à distiller est placé dans un ballon surmonté d’une colonne à distiller : colonne de Vigreux.
• On chauffe le ballon jusqu’à ébullition du mélange. Les vapeurs des différentes espèces chimiques montent dans la colonne à distiller, ce qui permet alors de séparer les différentes espèces chimiques.
• En tête de colonne à distiller, on trouve l’espèce chimique la plus volatile. Les autres se condensent et retombent dans le ballon.
• L’espèce chimique la plus volatile est condensée grâce au réfrigérant. On recueille le distillat.
Le matériau de référence est l'eau pour les solides et les liquides, l'air pour les gaz.
La densité d'un matériau se calcule par le rapport de sa masse volumique sur celle du matériau de référence. La densité est un nombre sans unité.
La densité des liquides et des solides correspond à :
La densité des gaz se calcule par la formule :

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








