Réaliser une expérience en utilisant un tableau d'avancement
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Établir le tableau d’avancement d’une transformation chimique et déterminer la composition de l’état final d’un système et l’avancement final de la réaction à partir de l’expérience.
- Une expérience consistant à réaliser une réaction chimique se réalise en respectant les étapes d’un protocole.
- À la fin de cette expérience, on en déduit la masse de produit formé.
- Le tableau d’avancement de la réaction support de cette réaction se remplit à partir de la quantité de matière initiale des réactifs, de l’avancement maximal de la réaction et des coefficients stœchiométriques.
- De ce tableau d’avancement, on en déduit la masse maximale de produit que l’on peut former.
- Réactifs et produits
- Équilibrer une équation chimique
- Quantité de matière, masse, masse
molaire, concentration massique et molaire pour pouvoir
calculer

Le tableau d’avancement est très utile lorsque l’on souhaite prévoir la masse d’un produit obtenu.
On s’intéresse ici à la synthèse d’un pigment organique, à l’issue de laquelle le produit formé est pesé. La masse obtenue expérimentalement est ensuite comparée à celle qui était attendue suite aux calculs du tableau d’avancement.
L’indigo est un pigment bleu qui existe à l’état naturel. Pour répondre aux besoins de l’industrie, on peut le synthétiser en laboratoire.
À l’état naturel, on extrait l’indigo de l’indigotier, un arbuste qui pousse dans des climats chauds de l’Afrique, l’Asie et l’Amérique.
La synthèse de l’indigo est réalisée selon un procédé proposé par Baeyer en 1882, en mélangeant du 2-nitrobenzaldéhyde avec de l’acétone.
Remarque : la structure de l’indigo (de formule C16H10N2O2) a été déterminée en 1926.
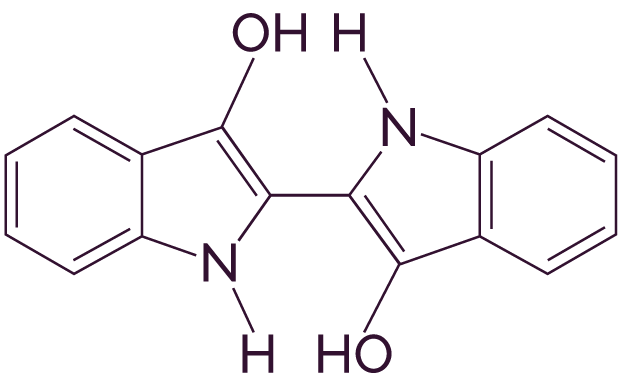
Structure de l’indigo
On réalise ici sa synthèse.
La synthèse de l’indigo nécessite l’utilisation du matériel de chimie suivant.
- Balance
- 2 coupelles en verre
- Spatule
- Entonnoir + papier filtre
- Erlenmeyer
- 4 éprouvettes graduées de 10 mL
- Agitateur magnétique + barreau aimanté
- Pipette
- Pissette d’eau distillée
Les solutions utilisées sont les suivantes.
- Solide : le 2-nitrobenzaldehyde C7H5NO3 ;
- Solution d’acétone C3H6O ;
- Solution d’hydroxyde de sodium (Na+(aq) + HO–(aq)), à la concentration CB = 5,0 mol·L–1 ;
- Solution d’éthanol.
La synthèse de l’indigo se réalise en respectant un protocole précis.
-
Réaliser le montage.
On réalise le montage suivant, puis on introduit le barreau aimanté dans l’erlenmeyer.
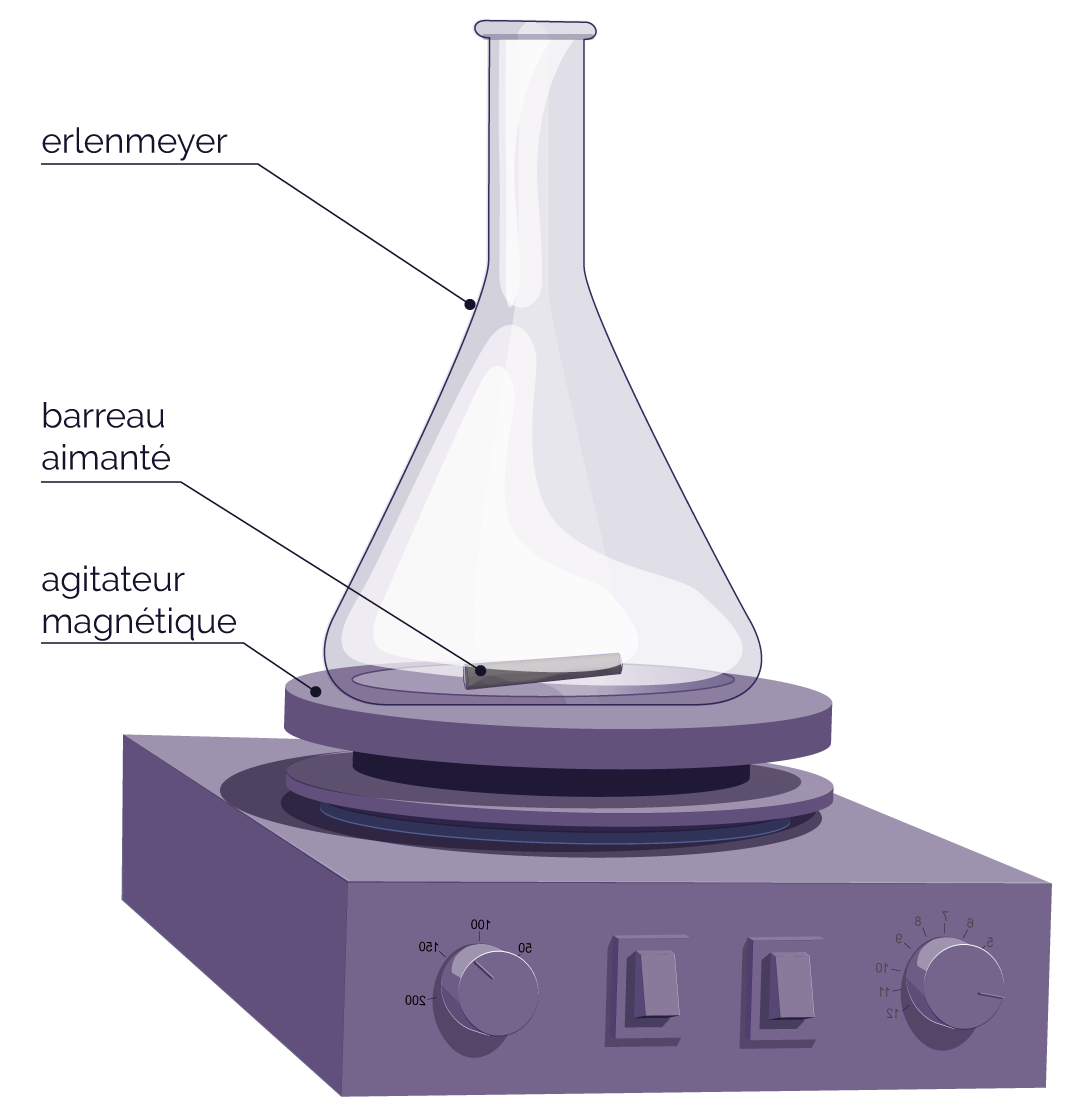
Schéma du montage -
Préparer les réactifs.
Peser 0,50 g de 2-nitrobenzaldéhyde C7H5NO3 dans une coupelle.
À l’aide de 4 éprouvettes graduée de 10 mL, prélever :- 5,0 mL d’acétone C3H6O ;
- 10 mL d’eau distillée ;
- 4,0 mL d’une solution d’hydroxyde de sodium (Na+(aq) + HO–(aq)) à la concentration CB = 5,0 mol·L–1 ;
- 10 mL d’éthanol.
-
Mélanger les réactifs.
Introduire le 2-nitrobenzaldehyde C7H5NO3 dans l’erlenmeyer, puis ajouter l’acétone C3H6O et l’eau distillée.
-
Mélanger le milieu réactionnel.
Mettre en route l’agitateur magnétique.
À l’aide d’une pipette simple, ajouter goutte à goutte l’hydroxyde de sodium.Remarque : le mélange s’échauffe et brunit ; l’indigo formé précipite. -
Filtrer.
Verser le contenu de l’erlenmeyer dans un dispositif de filtration.
Schéma de filtration du milieu réactionnel -
Rincer le filtrat.
Rincer le filtrat à l’eau distillée, puis avec l’éthanol.
Remarque : le lavage de l’indigo à l’éthanol permet d’éliminer les traces de 2-nitrobenzaldéhyde. -
Sécher le filtrat.
Récupérer le solide dans une coupelle et le sécher dans une étuve à 100 °C : on obtient l’indigo pur.
-
Peser.
Peser l’indigo obtenu : mexp = 0,22 g.
Remarque : cette masse obtenue va dépendre des conditions de l’expérience et de la précision des prélèvements.
L’équation de la réaction de synthèse de l’indigo est :
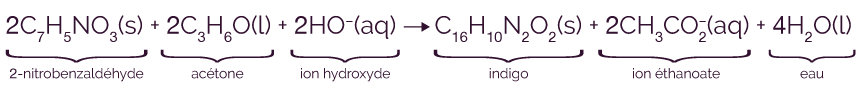
On remarque que la seule espèce solide formée est l’indigo, de formule C16H10N2O2. C’est la raison pour laquelle le mélange réactionnel a été filtré, pour le récupérer.
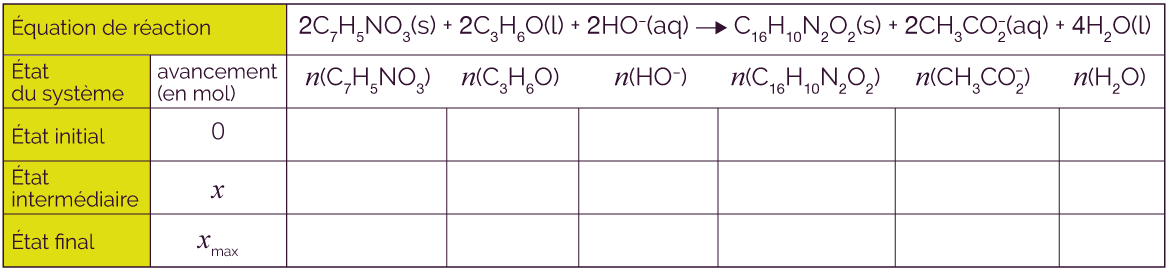
On utilise un tableau d’avancement pour calculer la masse théorique d’indigo qu’on aurait obtenu si la réaction avait été totale.
Données
- Masses molaires : M(C) = 12,0 g·mol–1 ; M(H) = 1,0 g·mol–1 ; M(O) = 16,0 g·mol–1 ; M(N) = 14,0 g·mol–1
- Masse volumique :
 (C3H6O) = 783 g·L–1
(C3H6O) = 783 g·L–1
-
Lister les données.
On liste les données de l’énoncé.
- m(C7H5NO3) = 0,50 g
- V(C3H6O) = 5,0 mL
- V = 4,0 mL d’une solution d’hydroxyde de sodium (Na+(aq) + HO–(aq)) à la concentration CB = 5,0 mol·L–1
On les convertit dans la bonne unité.
- V(C3H6O) = 5,0 mL = 5,0 × 10–3 L
- V(HO–) = 4,0 mL = 4,0 × 10–3 L
-
Calculer les quantités de matière
à l’état initial.
On calcule les quantités de matière initiales des réactifs à l’aide de l’énoncé.
-
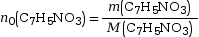 avec :
avec :
M(C7H5NO3) = 7 × M(C) + 5 × M(H) + 1 × M(N) + 3 × M(O)
M(C7H5NO3) = 7 × 12,0 + 5 × 1,0 + 1 × 14,0 + 3 × 16,0
M(C7H5NO3) = 151 g·mol–1
Ainsi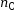 (C7H5NO3) =
(C7H5NO3) = 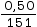 = 3,3 × 10–3 mol.
= 3,3 × 10–3 mol.
-
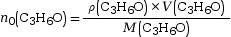 car
car 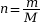 et
et 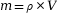 avec :
avec :
M(C3H6O) = 3 × M(C) + 6 × M(H) + 1 × M(O)
M(C3H6O) = 3 × 12,0 + 6 × 1,0 + 1 × 16,0
M(C3H6O) = 58 g·mol–1
Ainsi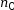 (C3H6O) =
(C3H6O) =
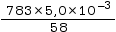 = 6,8 × 10–2 mol.
= 6,8 × 10–2 mol.
-
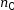 (HO–) = C × V(HO–) = 5,0 × 4 × 10–3 = 2 × 10–2 mol
(HO–) = C × V(HO–) = 5,0 × 4 × 10–3 = 2 × 10–2 mol
La quantité de matière des produits est nulle puisqu’ils ne se sont pas encore formés :
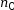 (C16H10N2O2) = 0 mol,
(C16H10N2O2) = 0 mol,
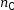 (
(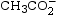 ) = 0 mol et
) = 0 mol et 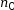 (H2O) = 0 mol.
(H2O) = 0 mol.
-
-
Remplir le tableau d’avancement.
On remplit le tableau d’avancement en tenant compte des coefficients stœchiométriques devant chaque élément chimique.
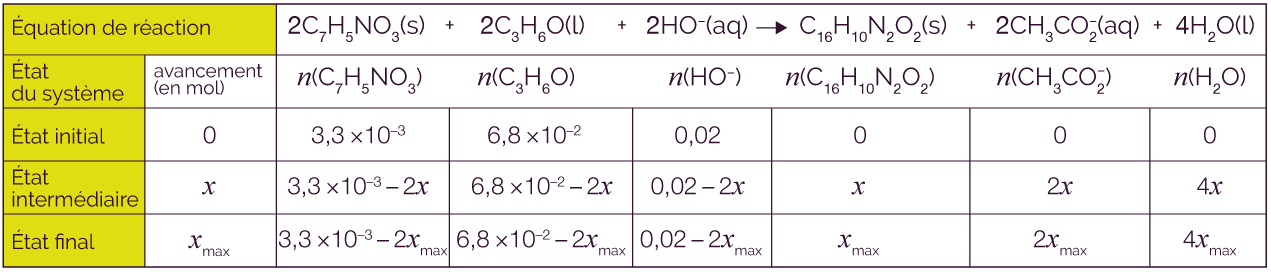
-
Calculer
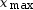 .
.
Pour déterminer l’avancement final
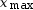 , on fait
3 hypothèses car il y a
3 réactifs.
, on fait
3 hypothèses car il y a
3 réactifs.
- Hypothèse 1 :
C7H5NO3 est le
réactif limitant, donc
3,3 × 10–3 – 2
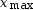 = 0,
soit
= 0,
soit 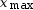 = 1,7 × 10–3 mol.
= 1,7 × 10–3 mol.
- Hypothèse 2 :
C3H6O est le réactif
limitant, donc
6,8 × 10–2 – 2
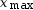 = 0,
soit
= 0,
soit 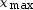 = 3,4 × 10–2 mol.
= 3,4 × 10–2 mol.
- Hypothèse 3 : HO– est
le réactif limitant, donc
0,02 – 2
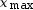 = 0, soit
= 0, soit
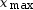 = 0,01 mol.
= 0,01 mol.
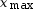 = 1,7 × 10–3 mol
car c’est la plus petite valeur. Le
réactif limitant est donc le
2-nitrobenzaldéhyde
C7H5NO3.
= 1,7 × 10–3 mol
car c’est la plus petite valeur. Le
réactif limitant est donc le
2-nitrobenzaldéhyde
C7H5NO3.
- Hypothèse 1 :
C7H5NO3 est le
réactif limitant, donc
3,3 × 10–3 – 2
-
Calculer la masse maximale d’indigo.
D’après la dernière ligne du tableau d’avancement,
 (C16H10N2O2) =
(C16H10N2O2) = 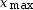 = 1,7 × 10–3 mol.
= 1,7 × 10–3 mol.
On peut donc en déduire la masse théorique de colorant indigo C16H10N2O2.
m(C16H10N2O2)théo = (C16H10N2O2) × M(C16H10N2O2) × m(C16H10N2O2)
(C16H10N2O2) × M(C16H10N2O2) × m(C16H10N2O2)
m(C16H10N2O2)théo = 1,7 × 10–3 × 151
m(C16H10N2O2)théo = 0,26 g
On peut maintenant comparer cette masse avec la masse expérimentale pesée à la fin de l’expérience.
- m(C16H10N2O2)exp = 0,22 g
- m(C16H10N2O2)théo = 0,26 g
Les 2 masses sont proches. Le tableau d’avancement nous a donc permis de faire une estimation de la masse d’indigo obtenue avec cette expérience.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !









