Déterminer une concentration à partir de la loi de Beer-Lambert
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Connaitre la loi de Beer-Lambert.
- Déterminer la concentration d’une solution à partir de son absorbance.
- Une solution colorée absorbe la lumière.
- L’absorbance A est une grandeur qui mesure l’absorption de la lumière par une solution colorée.
- L’absorbance dépend de la concentration de la solution et de la longueur d’onde de la lumière qui traverse la solution.
- La loi de Beer-Lambert donne la relation entre
l’absorbance A et la concentration
C :
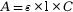 , avec :
, avec :
-
 le coefficient
d’extinction molaire en L·mol–1·cm–1 ;
le coefficient
d’extinction molaire en L·mol–1·cm–1 ;
-
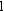 la largeur de la cuve
en cm ;
la largeur de la cuve
en cm ;
- C la concentration en quantité de matière de la solution en mol·L–1.
-
- Pour déterminer la concentration d’une solution inconnue, on peut réaliser une échelle de teinte ou réaliser une courbe d’étalonnage.
- Spectre UV-visible
- Concentration en quantité de matière
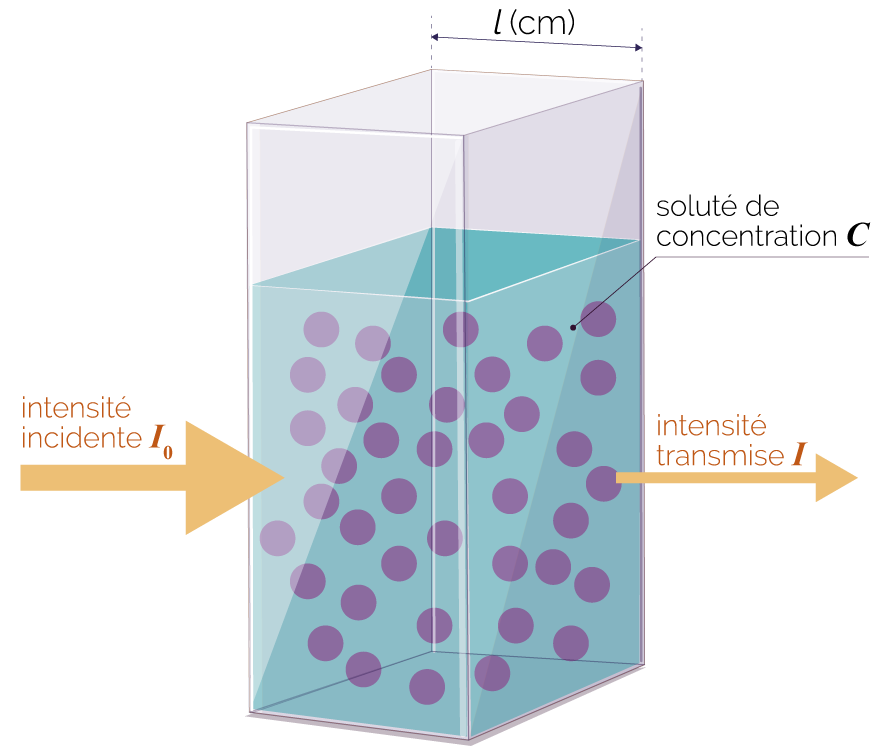
Une solution colorée absorbe une partie de la lumière qui la traverse.
L’absorbance d’une solution se mesure à l’aide d’un spectrophotomètre.
 Spectrophotomètre |
 Cuve pour spectrophotomètre |
On cherche à retrouver la formule de l’absorbance A. Pour cela, on fait varier différents paramètres et on observe comment évolue l’absorbance.
On étudie une solution de diiode de
concentration molaire fixe C = 1 × 10–4 mol·L–1.
À l’aide d’un
spectrophotomètre, on mesure
l’absorbance A de cette solution pour
différentes longueurs d’onde ![]() .
.
On obtient le spectre d’absorption ci-dessous.
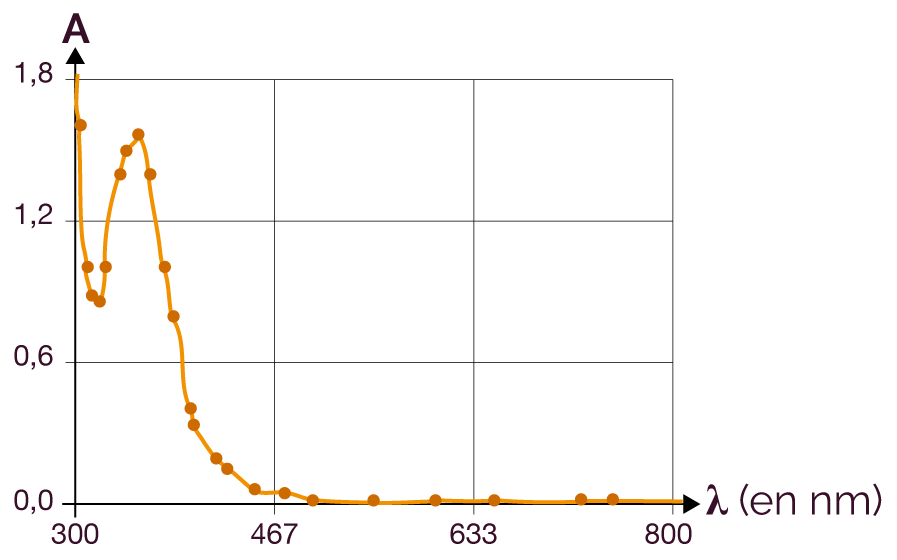
Représentation de l’absorption de la solution de diiode
en fonction de la longueur d’onde
On observe que la valeur de
l’absorbance A n’est pas la
même lorsque la longueur d’onde ![]() varie.
L’absorbance A dépend ainsi de
la longueur d’onde
varie.
L’absorbance A dépend ainsi de
la longueur d’onde ![]() de la lumière.
de la lumière.
On étudie plusieurs solutions de
diiode I2 de
différentes concentrations en quantité de
matière. On mesure l’absorbance de chacune
de ces solutions pour une longueur d’onde
fixe de ![]() = 400 nm.
= 400 nm.
On obtient la courbe ci-contre qui donne
l’absorbance A des solutions de
diiode en fonction de la concentration en
quantité de matière, pour une longueur
d’onde fixe de ![]() = 400 nm.
= 400 nm.
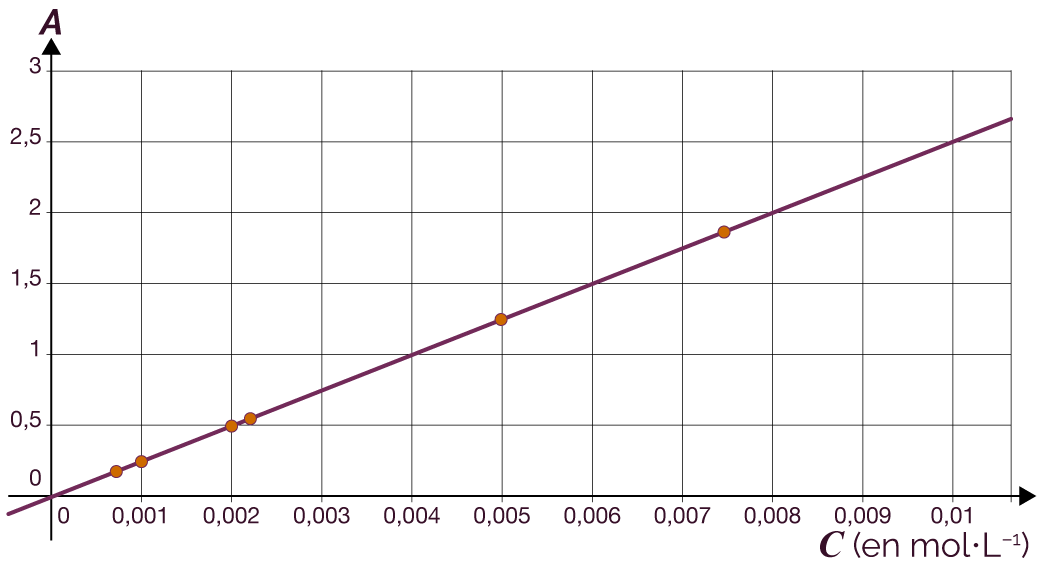
Représentation de l’absorption des solutions de diiode
en fonction de la concentration en quantité de matière
On remarque que la valeur de l’absorbance A varie en fonction de la concentration en quantité de matière C de la solution. La courbe est une droite qui passe par l’origine : l’absorbance A de la solution est donc proportionnelle à la concentration en quantité de matière C de la solution.
Cette relation est vérifiée pour des solutions de concentration inférieure à 0,1 mol·L–1.
Les données précédentes permettent
d’affirmer que
l’absorbance A dépend de la
longueur d’onde ![]() et est proportionnelle à
la concentration en quantité de
matière C de la solution.
et est proportionnelle à
la concentration en quantité de
matière C de la solution.
On peut de plus montrer de la même manière
que l’absorbance dépend de la
largeur ![]() de la solution
traversée : plus la
largeur
de la solution
traversée : plus la
largeur ![]() de la solution traversée
par le flux lumineux est importante, plus cette
solution va absorber.
de la solution traversée
par le flux lumineux est importante, plus cette
solution va absorber.
La « loi de Beer-Lambert » donne la
relation qui lie l’absorbance A, la longueur
d’onde ![]() , la concentration en
quantité de matière C et la
largeur
, la concentration en
quantité de matière C et la
largeur ![]() de la solution traversée,
dans la relation suivante.
de la solution traversée,
dans la relation suivante.
|
|
avec :
|
On considère une solution colorée de diiode I2 de concentration en quantité de matière C inconnue.
Les données relatives à cette solution sont les suivantes : A = 0,25 ;
On applique la loi de Beer-Lambert
Application numérique :

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








