Réaliser une chromatographie sur couche mince- Seconde- Physique Chimie
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Connaitre le montage d’une chromatographie sur couche mince.
- Connaitre les termes relatifs à la chromatographie sur couche mince.
- Exploiter le résultat d’une chromatographie sur couche mince.
- La chromatographie sur couche mince est une technique de séparation et d’analyse des mélanges homogènes.
- Elle utilise le principe de la migration par capillarité (comme sur un papier buvard) d’une espèce sur un support grâce à sa solubilité dans le solvant choisi.
- Ensuite, par comparaison avec des espèces pures de référence, il est possible de déterminer la nature des espèces chimiques isolées.
- Les règles de sécurité au laboratoire
- La réaction chimique
- La verrerie
- La solubilité
À l’origine, cette technique servait
à séparer des espèces chimiques
végétales colorées contenues dans
un mélange. Son nom vient d’ailleurs de la
racine grecque Khrôma et fut
employé pour la première fois par le
botaniste russe Mikhaïl Tswett en 1906
qui sépara les pigments d'une feuille
d'épinard.
La chromatographie est aujourd’hui une
méthode de séparation, mais
également d'identification des
constituants d’un mélange.
Les constituants d'un mélange homogène sont séparés par entrainement au moyen d'un solvant (nommé éluant ou phase mobile) sur un support (nommé phase fixe ou stationnaire).
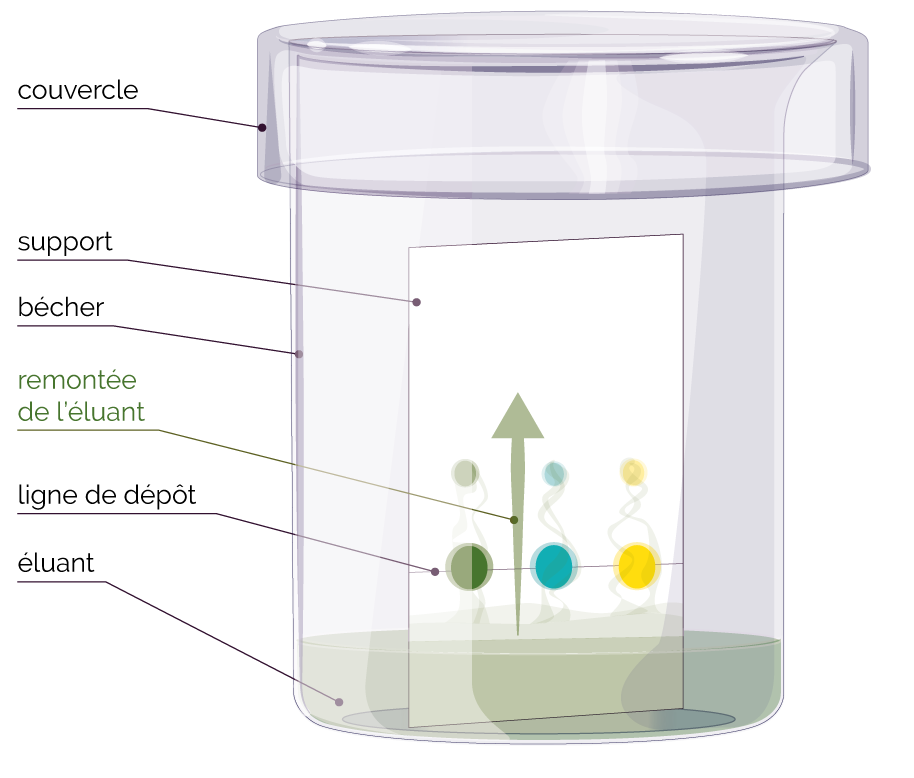
Dans le cas de la chromatographie sur couche
mince (C.C.M.), voici le principe
général.
- Une petite quantité du mélange à séparer est déposée sur le support (la plaque de chromatographie).
- Le support est ensuite placé au contact de l’éluant.
- L’éluant migre de bas en haut, par capillarité, le long du support.
- L’éluant entraine ainsi les constituants du mélange vers le haut du support. C’est le phénomène d’élution.
- Chaque constituant migre d’une certaine hauteur, caractéristique de la substance. C’est la migration différentielle.
- Il suffit alors de comparer la migration de ces constituants avec des espèces chimiques de référence ou témoins. C’est l’analyse comparative.
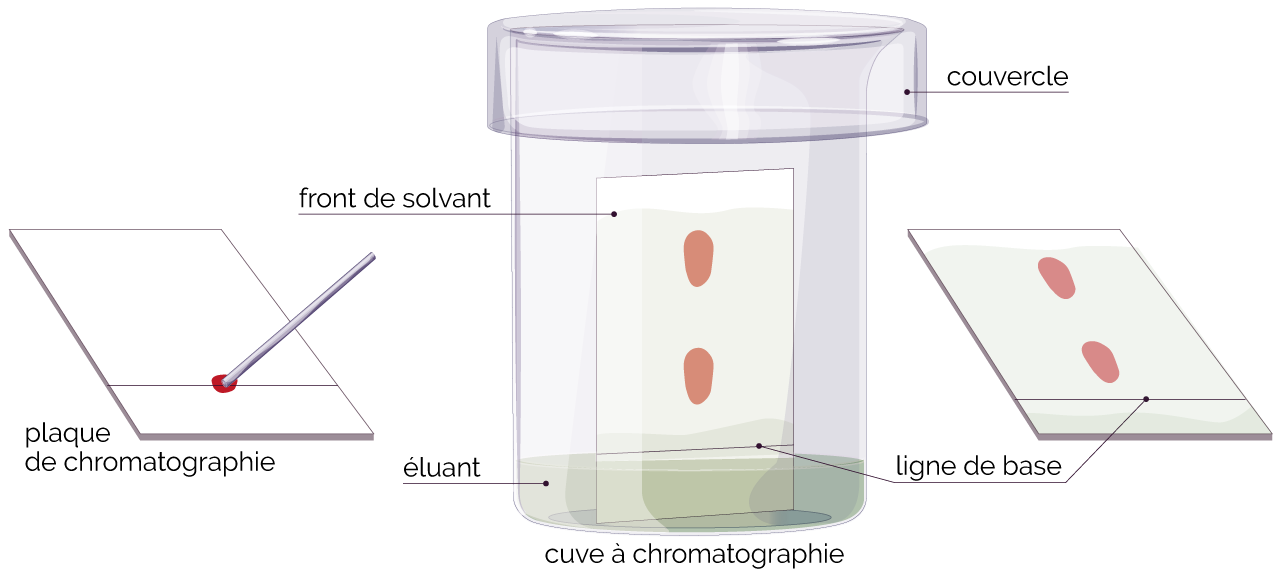
Chromatographie : montage et vocabulaire
Choix du support (phase fixe) et de l’éluant (phase mobile).
- Choix de la phase fixe (exemple : plaque d’aluminium recouverte de gel de silice).
- Choix de la phase mobile. C’est un solvant ou un mélange de solvants (exemple : dichlorométhane, éther de pétrole, etc.).
Préparation de la cuve à chromatographie et du support.
- On verse environ 0,5 à 1 cm d’éluant dans la cuve à chromatographie que l’on referme avec un couvercle de manière à ce que l’éluant sature la cuve en vapeur.
- On trace alors un trait fin appelé ligne de dépôt (ou ligne de base) sur la plaque à chromatographie de manière à ce que ce trait soit au-dessus du niveau de l’éluant.
Préparation des dépôts.
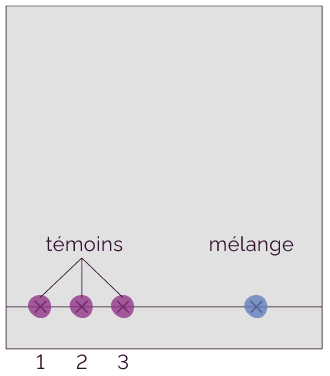
- Sur la ligne de base, on doit réaliser les
différents dépôts :
- le mélange ;
- les témoins : ce sont les produits susceptibles d’entrer dans la composition du mélange.
- On doit enfin sécher ces dépôts pour bien les fixer sur le support.
-
La plaque est placée dans la cuve à la verticale et le couvercle est remis en place.
- On laisse l’éluant migrer par capillarité.
- On sort la plaque lorsque ce dernier arrive à ~0,5 cm du haut de la plaque en y traçant un nouveau trait appelé front du solvant.
La tache constituée du mélange va migrer vers le haut en se divisant en autant de taches qu’il y a de constituant.
Révélation et analyse du chromatogramme par comparaison.

Les taches ne sont pas nécessairement visibles.
Parfois, il est nécessaire de plonger la plaque
dans un révélateur qui va les rendre
visibles.
On compare la hauteur des taches issues du mélange
à celles des témoins.
Le constituant du témoin n° 1 n’est pas présent dans le mélange car la tache correspondante n’est à la hauteur d’aucune tache issue du mélange.
On considère les colorants alimentaires vendus dans le commerce.
- Le colorant rouge est codé, selon la nomenclature internationale, E122 (azorubine).
- Le colorant jaune est codé E102 (tartrazine).
- Le colorant vert n'est quant-à-lui pas codé : il s'agit du mélange homogène à étudier.
Étapes 1 à 3
On dépose sur la ligne de base d’un papier filtre une goutte de chaque colorant, côte à côte.
 Montage pour une
chromatographie de colorants alimentaires
Montage pour une
chromatographie de colorants alimentaires
- Le support est alors positionné dans une cuve
fermée contenant de l'eau salée
(éluant).
L'eau salée doit imbiber le bas du support sans toucher les gouttes de colorant. - On laisse l'éluant monter par capillarité sur le support et on arrête l'expérience lorsque le front de l'éluant atteint le haut du support.
Étape 5
Le résultat de l'expérience montre que les colorants ne sont pas montés à la même vitesse. Ils ne sont donc pas à la même hauteur lorsqu'on enlève le support du bécher.
 Chronologie d'une
chromatographie de colorants alimentaires
Chronologie d'une
chromatographie de colorants alimentaires
Le colorant vert est effectivement un mélange
homogène constitué de deux colorants :
le jaune tartrazine (E102) et le bleu
patenté (E131).

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








