La synthèse des protéines
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Comprendre comment se déroule la traduction et le rôle des ribosomes.
- Comment les protéines deviennent fonctionnelles.
- Les trois étapes de la traduction : initiation, élongation et terminaison.
- Les protéines sont rendues fonctionnelles par leurs repliements 3D.
- Le lieu d’action des protéines se retrouve soit au niveau de la séquence en acide aminé, soit par la présence de molécules glycosylées.
- La transcription : de l’ADN à l’ARNm.
- Le code génétique : nucléotides, codons et acides aminés.
L'ARN messager produit dans le noyau passe dans le cytoplasme après maturation pour y être traduit : c'est la synthèse des protéines. Cet ARN messager est porteur d’une information génétique. Elle se déroule en trois étapes : l’initiation, l’élongation et la terminaison.
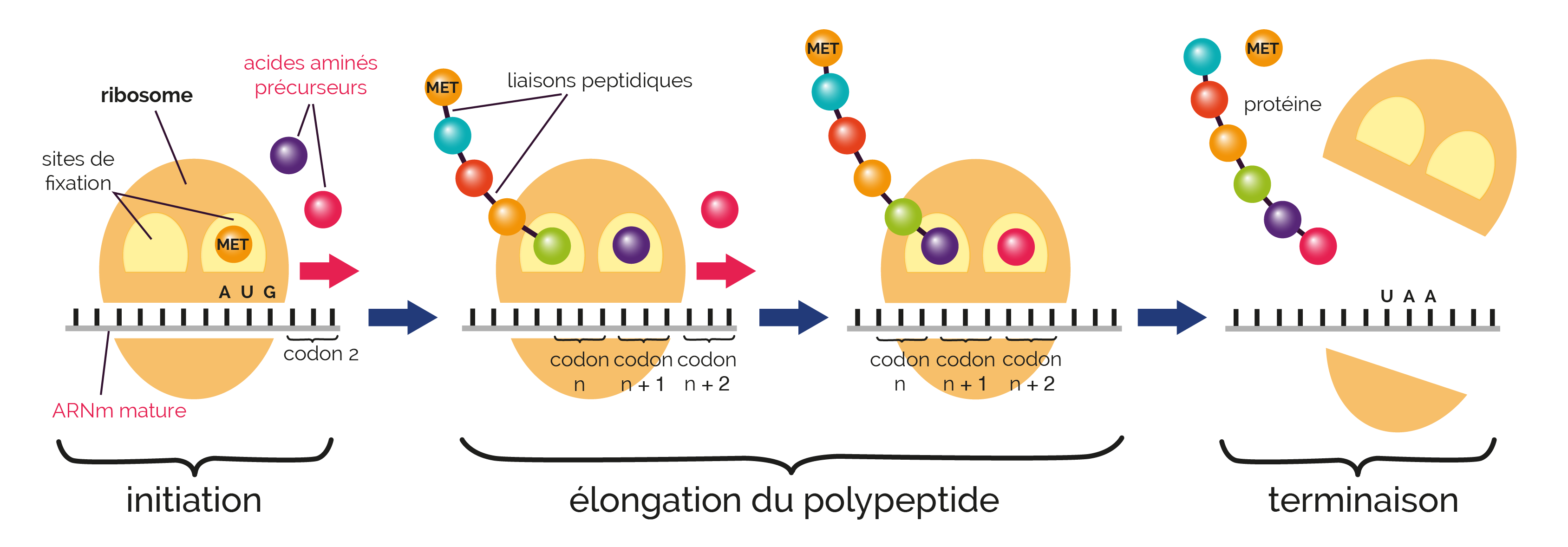
La traduction
Le ribosome, petit organite cytoplasmique (« atelier d'assemblage des protéines ») commence la lecture du gène dont la séquence est copiée sur l'ARN messager. Il reconnaît un endroit de la molécule appelé codon initiateur (AUG). Chaque ribosome est formé de deux sous-unités : la petite sous-unité porte un site de lecture de l'ARN messager et la grosse sous-unité présente un site catalytique. Un ribosome se comporte par conséquent comme une enzyme caractérisée par un site actif. Il catalyse la polymérisation des acides aminés de la protéine qui est en train de se former.
Il existe deux types de ribosomes :
- les ribosomes libres qui permettront la synthèse des protéines cytoplasmique et des protéines intervenant dans les réactions métaboliques des organites (enzymes).
- les ribosomes fixés à la membrane du réticulum endoplasmique qui permettront la synthèse des protéines transmembranaires (protéines coincées dans une membrane plasmique).
Le déplacement relatif du ribosome et de l'ARN messager s'accompagne de l'allongement progressif de la chaîne polypeptidique ; à chaque triplet de nucléotides de l'ARN messager correspond un acide aminé précis qui s'incorpore à la chaîne polypeptidique en formation. La correspondance entre les triplets de nucléotides de l'ARN messager et les acides aminés s'effectue selon les principes du code génétique.
La prise en charge de chacun des 20 acides aminés s'effectue grâce à des ARNt (ARN transfert) spécifiques dont une partie se fixe sur chaque codon. Une liaison peptidique permet l'accrochage de chaque nouvel acide aminé (apporté par un ARNt) au dernier acide aminé de la chaîne en cours d'élongation. Le nouvel acide aminé arrivant devient provisoirement à son tour le dernier.
Le ribosome parvient sur un des trois codons « stop » ou « non sens », codon auquel ne correspond aucun acide aminé. La dissociation entre l'ARN messager et la chaîne polypeptidique terminée s'effectue alors.
La traduction de l’information d’un gène se fait en deux étapes :
- Par le biais du code génétique en partant de codons de trois nucléotides pour obtenir une séquence en acide aminé.
- Par le repliement de la séquence en acide aminé qui va donner une structure tridimensionnelle à la protéine qui va lui conférer la formation de sites actifs et une stabilité (formation de pont disulfure, de liaisons hydrogènes et de pôles hydrophobes/hydrophiles ).
Le repliement s’effectue au cours de la synthèse des protéines lorsque la séquence polypeptidique ressort du ribosome. Des protéines appelées chaperonnes aident les acides aminés d’une même séquence à se positionner correctement.
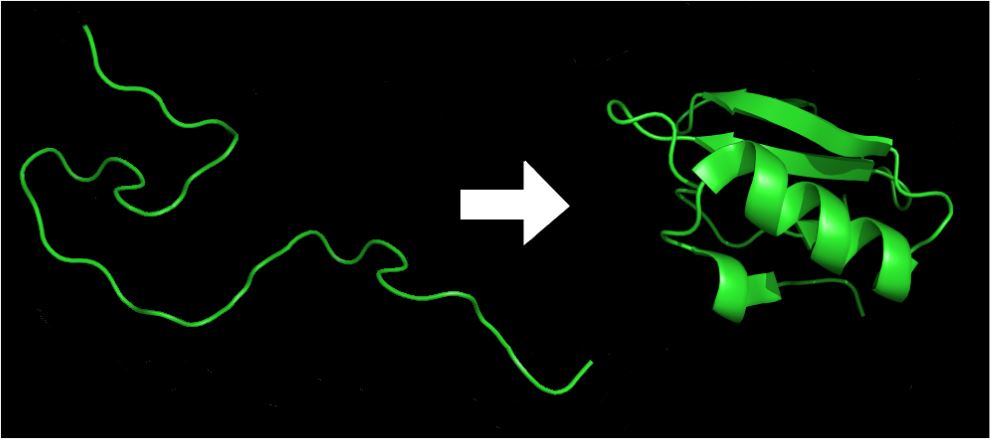
Le repliement d'une protéine
Souvent le lieu de synthèse et le lieu d’action des protéines sont différents. Pour se rendre sur leur lieu d’action (ou d’adressage), elles doivent subir quelques modifications en passant dans différents compartiments cellulaires (réticulum endoplasmique et appareil de Golgi).
Certains lieux d’adressage sont codés par les acides aminés à la fin de la séquence de la protéine ou par la présence de molécules glycosylées (sucres).
| Séquence | Fonction |
| +H3N-Met-Met-Ser-Phe-Val-Ser-Leu-Leu-Leu-Val-Gly-Leu-Leu-Phe-Trp-Ala-Thr-Glu-Ala-Glu-Gln-Leu-Thr-Lys-Cys-Glu-Val-Phe-Gln | Importation dans le réticulum endoplasmique |
| -Lys-Asp-Glu-Leu-COO- | Rétention dans la lumière du réticulum endoplasmique |
| +H3N-Met-Leu-Ser-Leu-Arg-Gln-Ser-Leu-Arg-Phe-Phe-Lys-Pro-Ala-Thr-Arg-Thr-Leu-Cys-Ser-Ser-Arg-Tyr-Leu-Leu- | Importation dans les mitochondries |
| -Pro-Pro-Lys-Lys-Lys-Arg-Lys-Val- | Importation dans le noyau |
| -Ser-Lys-Leu- | Importation dans les peroxysomes |

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !









