La solubilité d'un solide dans l'eau
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Estimer expérimentalement la valeur de la solubilité d’un solide dans l’eau.
- Observation microscopique de la solubilité.
- Différencier solubilité et miscibilité.
Niveau préconisé : 3e
- Dans une solution il y a un soluté (particules solides) et un solvant (généralement l’eau). Dans ce cas la solution est dite aqueuse.
- Lorsqu'un solide ne peut plus se dissoudre, on dit que la solution est saturée.
- La solubilité caractérise la possibilité d’une espèce chimique solide à pouvoir se dissoudre dans un liquide. Elle s’exprime généralement en g/L.
- La saturation d’une solution est obtenue lorsqu’une quantité supplémentaire de solide ne peut plus se dissoudre dans le liquide. Les différentes espèces chimiques ont des limites de solubilité différentes.
- Il est courant de confondre solubilité et
miscibilité. La différence s’explique
au niveau microscopique (molécules ou ions) :
- Pour la solubilité : les molécules de la substance introduite dans la substance se transforment en ions et deviennent des particules indépendantes qui se répartissent de façon aléatoire et homogène.
- Pour la miscibilité : les molécules de chacun des liquides restent entières, mais se répartissent de façon aléatoire et homogène.
On exprime généralement la solubilité en g/L.
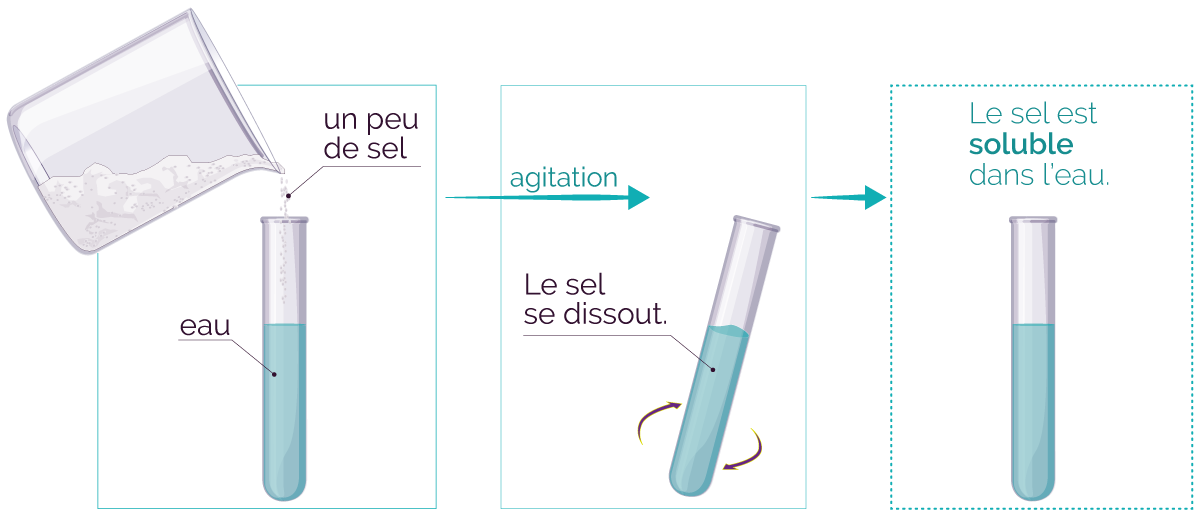 Solubilité du sel dans
l'eau
Solubilité du sel dans
l'eau
On ne peut pas dissoudre n’importe quelle masse de soluté (substance chimique solide) dans un volume donné de solvant (substance chimique majoritaire). Il y a une quantité limitée et lorsqu'on la dépasse, on dit que la solution est saturée.
Dans ce cas le solide ne se dissout plus et reste alors visible.
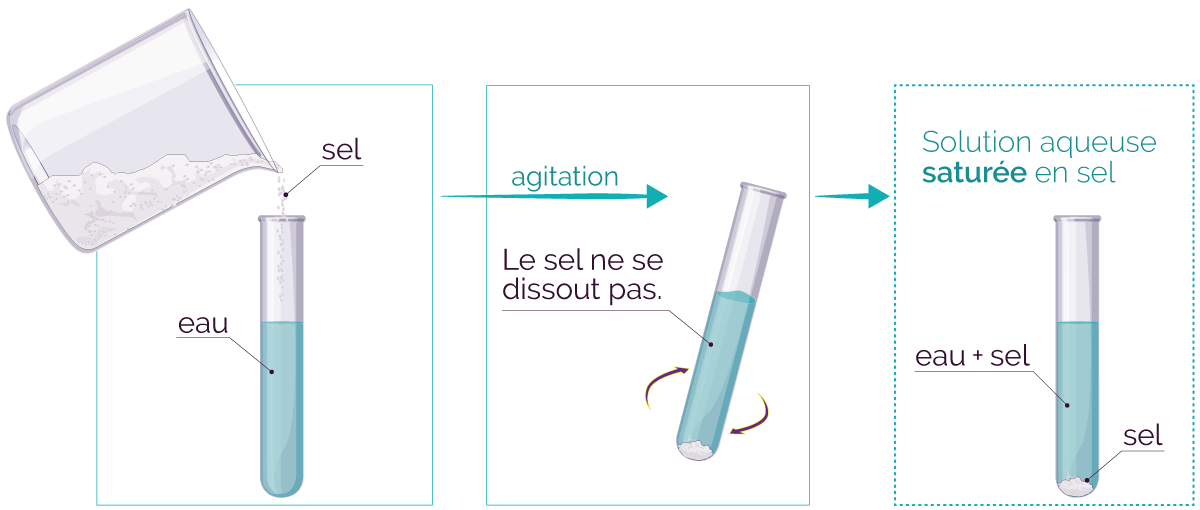 Saturation de l'eau en sel
Saturation de l'eau en sel
La solubilité concerne un solide dans un liquide, mais aussi un gaz dans un liquide (eau gazéifiée par exemple) ou un liquide dans un autre liquide.
Si on dépasse une quantité limite de masse de soluté qui peut être dissout dans un volume donné de solvant, la solution est saturée.
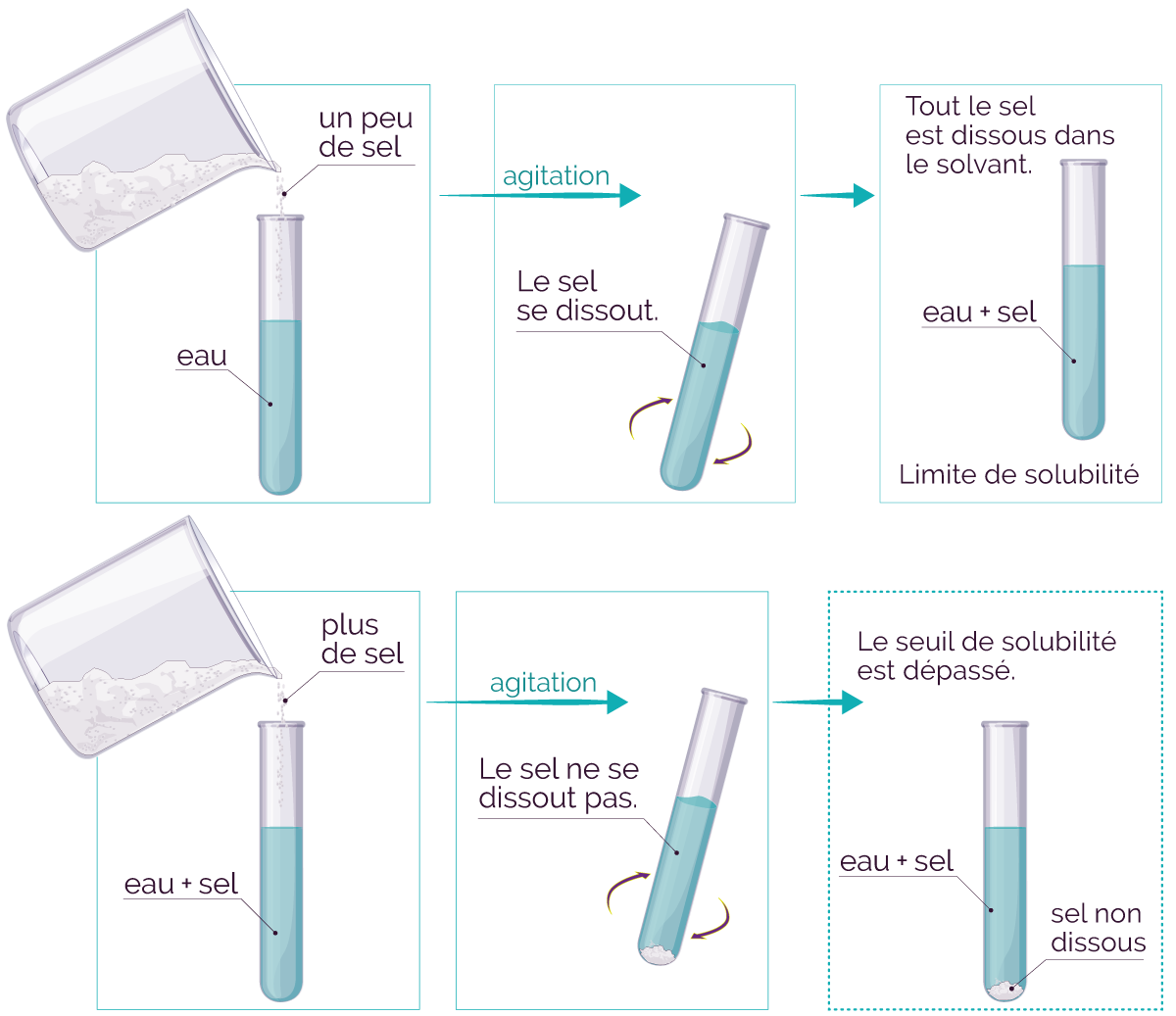
On peut déterminer la valeur de la solubilité maximale d’une espèce chimique dans un liquide, en appliquant le protocole suivant.
- Pour une quantité d'eau de 200 mL placée dans une éprouvette graduée, on ajoute progressivement du sel par quantité de 10 g jusqu'à environ 60 g.
- Puis on diminue les quantités de sel en ajoutant 2 g par 2 g jusqu'à ce que le sel ne se dissolve plus.
 Détermination
expérimentale du seuil de solubilité du sel
dans l'eau
Détermination
expérimentale du seuil de solubilité du sel
dans l'eau
On remarque que le sel ne se dissout plus lorsqu'on a versé 68 g.
On en déduit alors que la limite de solubilité du sel à température ambiante dans l’eau est égale à 68 g pour 200 mL, soit 340 g (6 × 85) par litre d’eau.
La méthode décrite ci-dessus considère que le volume total (eau + sel) n’a pas varié par rapport au volume de départ.
Voici quelques exemples du seuil de solubilité de différentes espèces chimiques, dans l’eau, à la température de 20 °C.
| Composés chimiques | Chlorure de sodium (sel) | Diiode | Carbonate de calcium | Sulfate de cuivre |
| Solubilité (en g/L) | 360 | 0,33 | 0,0153 | 220 |
La solubilité d’une substance varie avec de nombreux paramètres dont la température, la pression et bien d’autres encore.
Une espèce chimique est dite soluble lorsque toutes les molécules de l’espèce se transforment en deux formes ioniques différentes, en ions positifs (cations) et en ions négatifs (anions).
Dans ce cas, les différents ions se répartissent de façon aléatoire et homogène, dans tout le volume de la solution.
Les cristaux de sel (sous la forme de molécules) se dissolvent dans l’eau et se transforment en ions (ions chlorures et en ions sodium).
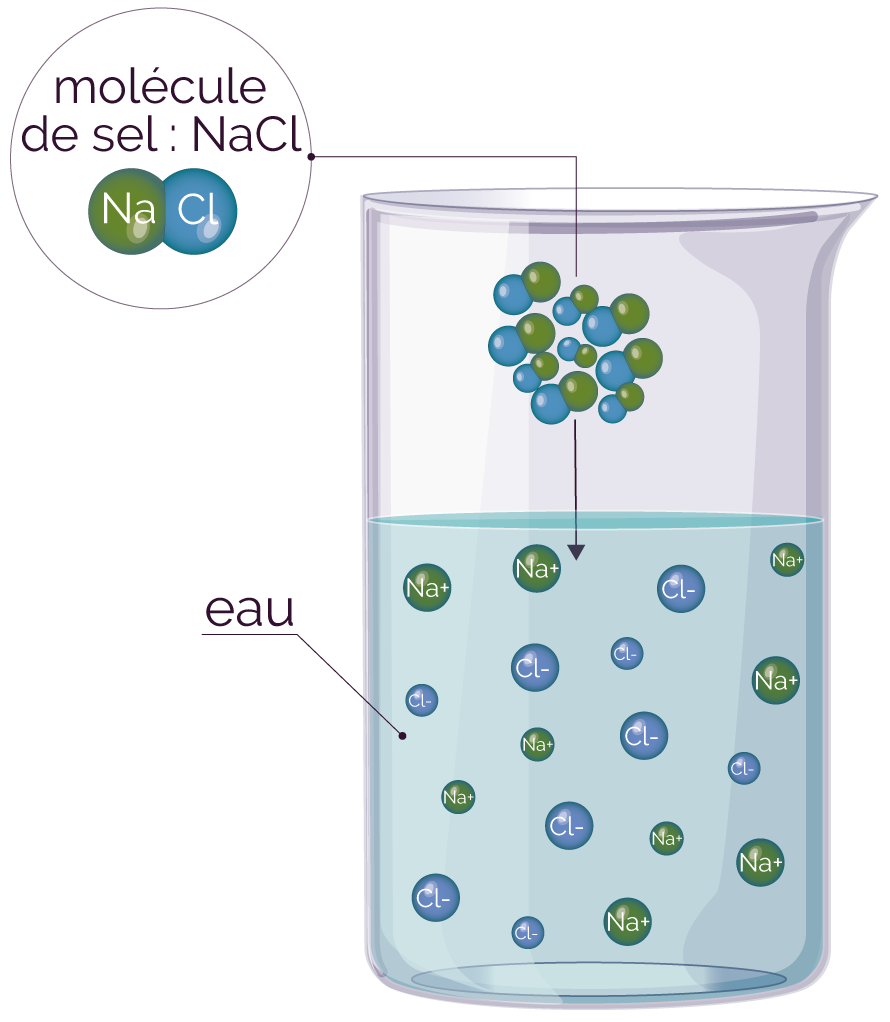 Solubilité du sel dans
l'eau
Solubilité du sel dans
l'eau
Il est courant de confondre solubilité et miscibilité. La différence s’explique au niveau microscopique.
Pour la miscibilité, les molécules de chacun des liquides restent entières (elles ne se transforment pas), mais se répartissent de façon aléatoire et homogène.
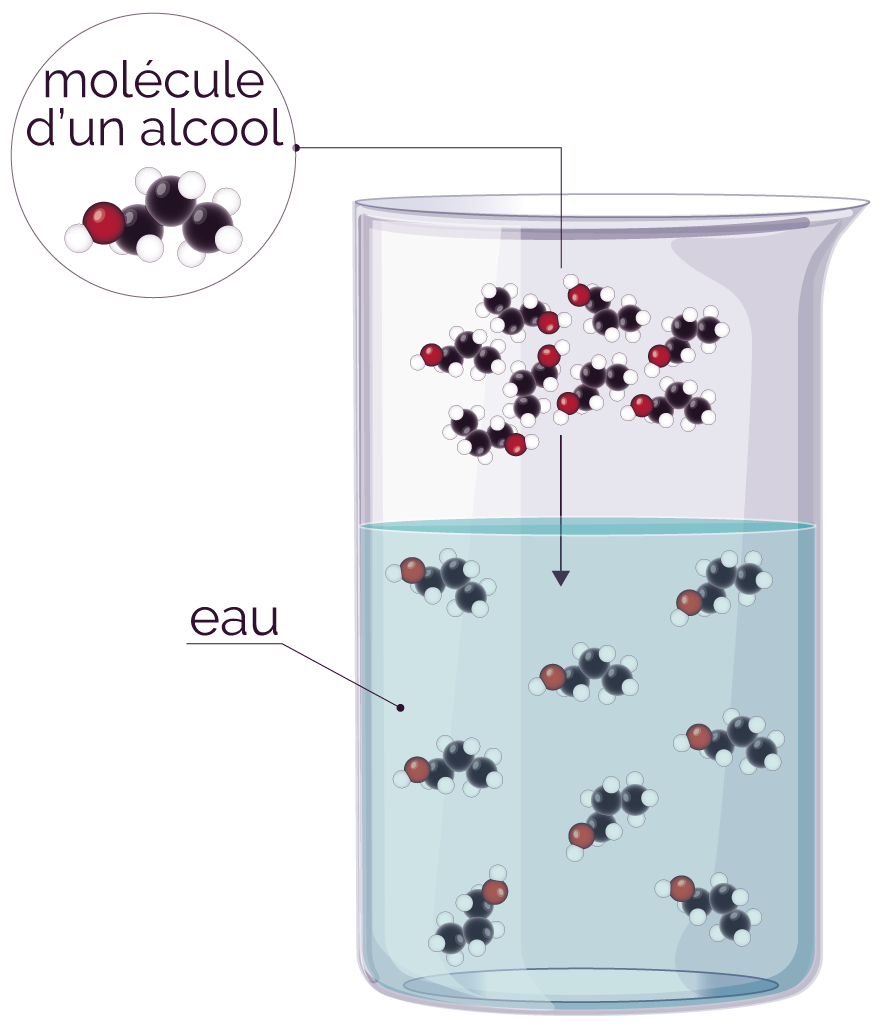 Miscibilité d'un
alcool dans l'eau
Miscibilité d'un
alcool dans l'eau

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








