Histoire du modèle de l'atome
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Connaitre l'histoire du modèle de l'atome.
Niveau préconisé : 3e
- La notion d’atome apparait au 5e siècle avant J.–C., grâce à Démocrite, un philosophe grec. Il considère que la matière est constituée de petites particules, invisibles et insécables (qui ne peuvent pas être coupées). Cette théorie est oubliée jusqu’au début du 19e siècle.
- Des scientifiques (Dalton puis Thomson), affirment alors l’existence de l’atome et ils en découvrent la structure générale.
- Rutherford propose ensuite un modèle planétaire de l'atome (où les électrons gravitent autour du noyau comme les planètes autour du Soleil). Il découvre pour cela l’existence du noyau, situé au centre de l’atome.
- Un peu plus tard, le chimiste Bohr développe le modèle de l’atome, en expliquant que les électrons ont une trajectoire bien précise autour du noyau.
- La trajectoire des électrons est ensuite affinée par le physicien Schrödinger. Il découvre en effet qu’il n’est pas possible de savoir où se trouve un électron car ils n’ont pas de trajectoire bien définie, comme le pensait Rutherford.
La matière est constituée de petits « grains » invisibles à l'œil nu : les atomes.
Même si les études sur l'atome n'ont vraiment débuté qu'au début du 19e siècle, la notion d’atome n’est pas récente.
Elle apparait au 5e siècle avant J-C grâce à Démocrite, un philosophe grec. Il considère que la matière est constituée de petites particules, invisibles et insécables (qui ne peuvent pas être coupées).
Cependant, Démocrite ne reçoit pas d’appui et c’est la théorie des quatre éléments (l’eau, le feu, la terre et l’air) qui domine jusqu’au début du 19e siècle.
Le chimiste anglais John Dalton démontre que les éléments chimiques réagissent entre eux dans des proportions massiques bien définies.
|
Dans le modèle de Dalton, les atomes sont des boules de tailles identiques mais de masses différentes. Tous les atomes d’un même élément sont identiques et ont la même masse. Les atomes d’éléments différents sont différents. |

Modèle de Dalton
|
L’anglais Joseph John Thomson étudie les tubes cathodiques.
Un tube cathodique est un tube de verre avec une électrode métallique à chaque extrémité. Lorsqu’on applique une tension électrique entre les deux électrodes, on observe un rayonnement en ligne droite entre les deux électrodes.
Thomson constate qu’avec un aimant le rayonnement cathodique est dévié. Cela prouve que le rayonnement est électriquement chargé. Thomson confirme ainsi l’hypothèse émise par des scientifiques anglais selon laquelle un courant de particules chargées négativement circule dans le rayonnement cathodique. Thomson découvre ainsi l’électron, une particule chargée négativement plus petite que l’atome de Dalton.
|
Plus tard, en 1904, Thomson propose un modèle atomique, appelé « le pudding de Thomson ». D’après ce modèle, l’atome est une sphère remplie d’une substance chargée positivement et dans laquelle baignent les électrons. |
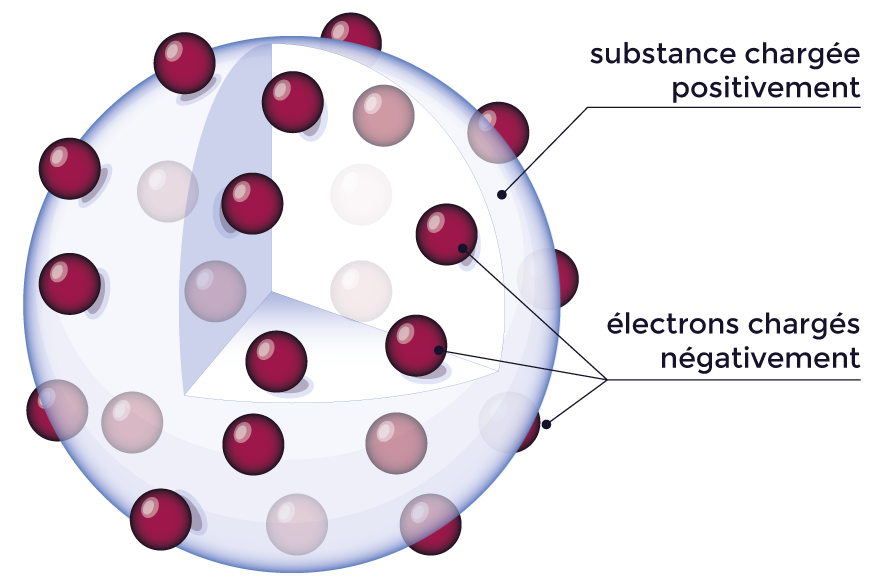
Modèle de l’atome
de Thomson : le pudding
|
En 1911, Ernest Rutherford, un chimiste néo-zélando-britannique, réalise une expérience majeure.
|
Il bombarde une mince feuille d’or avec des particules alpha (atomes d’hélium ayant perdu 2 électrons) émises par un corps radioactif. Il observe alors que la majorité des particules ont traversé la feuille d’or sans être déviées. Cependant, une minorité a été déviée et d’autres sont entrées en collision avec une particule très massive. |
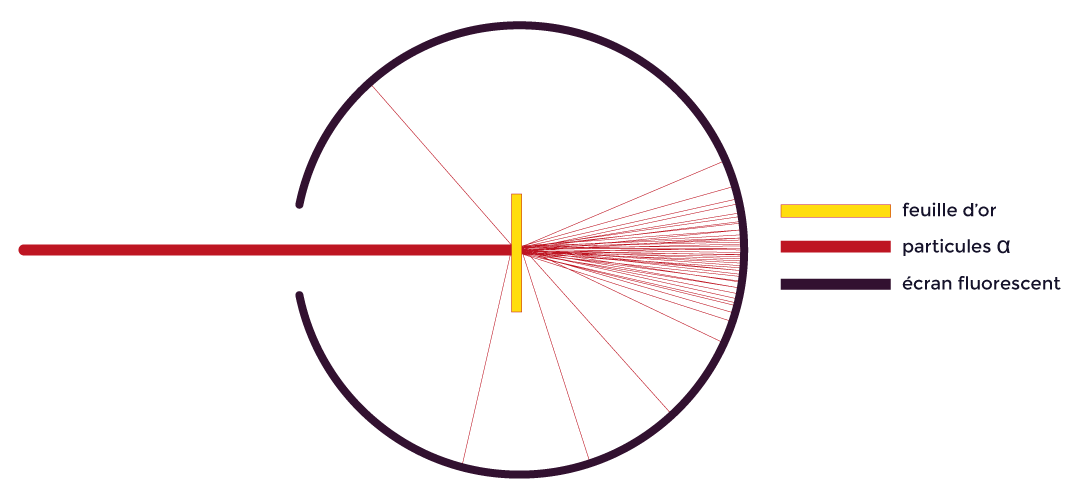
Expérience de Rutherford
|
Il en déduit que les atomes sont principalement constitués de vide (rayonnements non déviés) et que les déviations et collisions sont dues à la présence d’une particule très massive et chargée positivement : le noyau.
|
Rutherford propose alors un modèle de l’atome appelé modèle planétaire dans lequel l’atome est constitué d’un noyau autour duquel tournent les électrons. La neutralité de l’atome impose que la somme des charges des électrons est égale à la charge du noyau. La quasi totalité de la masse de l’atome est concentrée dans le noyau. |
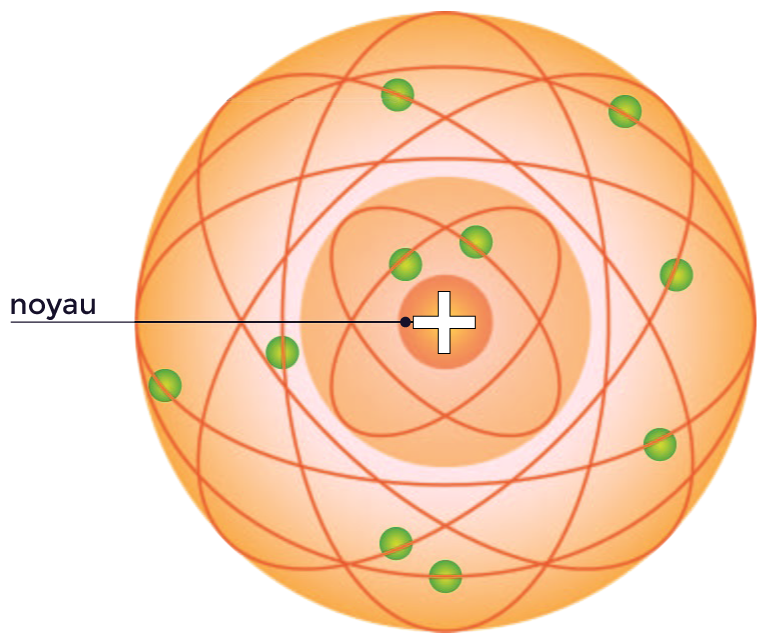
Modèle planétaire
de Rutherford
|
Toujours en bombardant des atomes avec des particules alpha, Rutherford dévoile l’existence des protons dans le noyau.
Le physicien danois Niels Bohr améliore le modèle de Rutherford lorsqu’il découvre que l'électron de l'atome d'hydrogène n'a accès qu'à certains niveaux d'énergie.
|
D’après son modèle, les électrons se répartissent sur des couches. Pour accéder à une couche plus éloignée du noyau, il doit acquérir une certaine quantité d’énergie appelée un quantum. Mais cet état est instable. De ce fait, il retourne sur la couche inférieure en libérant le quantum d’énergie sous forme de lumière. C’est le début de la théorie quantique. |
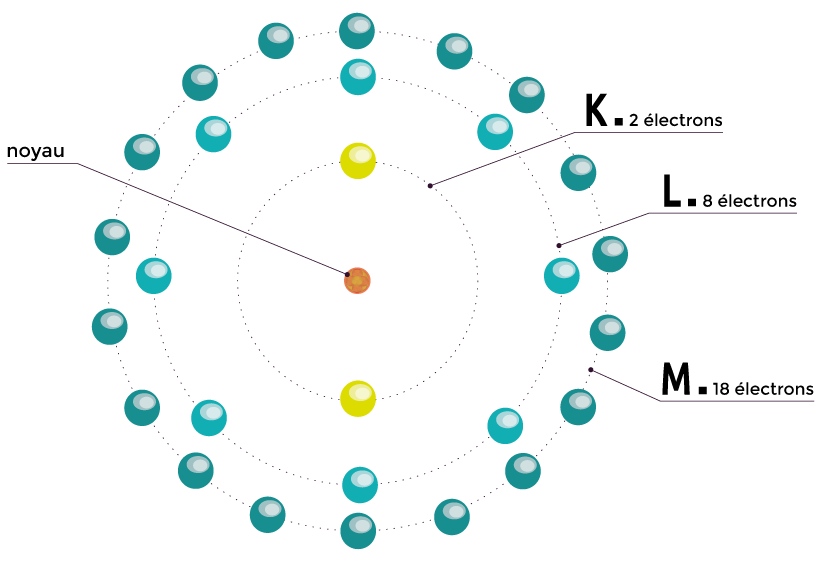
Modèle de Bohr
|
Entre 1930 et 1932, des spécialistes de la radioactivité réalisent 3 expériences dont les résultats sont confirmés et affinés par le physicien britannique James Chadwick en 1932.
En bombardant un noyau de béryllium avec un rayonnement alpha, les scientifiques ont détecté l’éjection d’une nouvelle particule, électriquement neutre : le neutron.
Le modèle de l’atome constitué d’électrons (chargés –) répartis en couches qui gravitent autour d’un noyau lui-même constitué de protons (chargés +) et de neutrons (neutres) est le modèle enseigné au lycée.
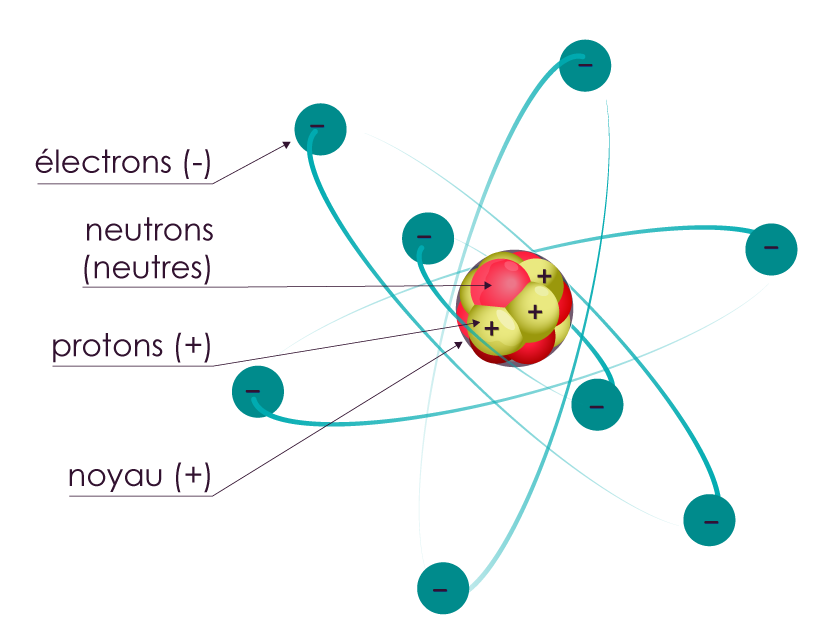
|
Modèle de l’atome avec :
|
Ce modèle est facilement compréhensible car il fait appel à des notions de mouvements, de positions, de billes que nous connaissons bien pour les côtoyer depuis toujours à l’échelle macroscopique.
Cependant, ce n’est qu’un modèle et à l’échelle de l’atome des phénomènes complexes apparaissent.
Au cours des années 1930, la théorie quantique fait son apparition.
Le physicien allemand Erwin Schrödinger prouve que les électrons n’ont pas une trajectoire bien déterminée. Il existe des endroits (appelés « orbitale ») dans lesquels les électrons sont le plus présent. On parle alors de probabilité de présence de l’électron.
Cette mécanique quantique est depuis cette époque une théorie faisant appel à des notions très abstraites.
D’après l’équation de Schrödinger, il est impossible de connaitre à la fois la vitesse et la position d’un électron.


Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








