Vitesse volumique de réaction et temps de demi-réaction
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Les quantités de réactifs ou de produits peuvent être déterminées par diverses méthodes.
Comment un système chimique évolue-t-il en fonction du temps ?
Comment définit-on la vitesse d’une transformation chimique ?
Qu’appelle-t-on temps de demi-réaction ?
Plaçons dans un bécher V = 50 mL d’une
solution d’eau oxygénée
(H2O2) (solution incolore), de
concentration C = 0,20 mol.L-1.
Versons dans cette solution V’ = 50 mL d’une
solution de iodure de potassium (K+ + I-)
acidifié (solution incolore) de concentration C’ =
0,20 mol.L-1.
La solution devient progressivement jaune, puis brune. La solution est très foncée au bout de plusieurs minutes, car du diiode se forme au cours de la transformation.
Le suivi temporel de la transformation peut se faire par
spectrophotométrie.
On détermine ainsi l’évolution de la
concentration en diiode I2 en
fonction du temps.
La réaction d’oxydoréduction met en jeu les couples I2/I- et H2O/ H2O2.
L’équation de la réaction d’oxydoréduction s’écrit :
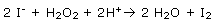
Le tableau donnant l’absorbance en fonction du temps permet donc de tracer l’évolution de la concentration [I2] en fonction du temps, reproduit sur la figure ci-dessous :
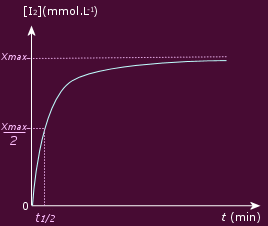
Cette courbe permet d’étudier
l’évolution temporelle du système chimique en
fonction du temps, et de définir la vitesse de la
réaction.
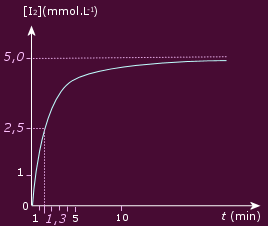
La variation de la concentration est rapide au début, et devient de plus en plus lente : l’évolution du système est de moins en moins rapide au cours du temps.
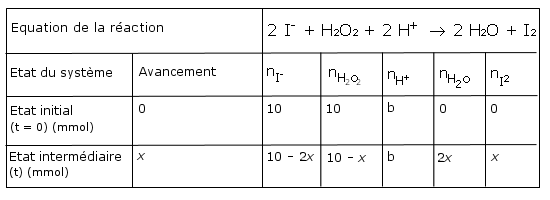
À l’état
initial :
nH2O2 = CV = 50.10-3. 0,20 =
1,0.10-2 mol = 10 mmol
nI- = C’V’ = 50.10-3. 0,20 =
1,0.10-2 mol = 10 mmol
Les ions H+ sont en excès, dans le tableau,
on note « b » pour beaucoup (la
quantité exacte n’est pas importante).

La vitesse volumique d’une réaction correspond à la quantité de matière formée ou disparue par unité de temps et de volume. Elle est liée à la variation de l’avancement x de la réaction en fonction du temps, soit à la dérivée de l’avancement par rapport au temps.
Par définition, on appelle vitesse volumique de réaction v la grandeur :

Dans l’expérience, la vitesse volumique de la réaction diminue au cours du temps.
La vitesse de la réaction peut être déterminée graphiquement : elle est proportionnelle au coefficient directeur de la tangente à la courbe en un point d’abscisse t donné.
On appelle temps de réaction
t1/2 la durée au bout de
laquelle l’avancement x est égal à la
moitié de l’avancement maximal
xmax.
Cette grandeur s’exprime en seconde (s).
Dans l’expérience, l’avancement maximal est
xmax = 5,0 mmol.
On détermine graphiquement le temps de
demi-réaction, qui correspond à la durée
nécessaire pour que x = 2,5 mmol.
On lit sur le graphique : t1/2
= 1,3 min.
Remarque :
On peut considérer que la transformation est
terminée à t = 5 min, ce qui ne correspond pas
à 2 t1/2.
Le temps de demi-réaction ne correspond pas à la
moitié de la durée nécessaire pour que la
transformation soit terminée.


Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !







