Principe des techniques mises en jeu pour élaborer un "produit" : séparation, électrolyse, formulation, conditionnement
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
A de nombreux niveaux, l’élaboration d’un produit consommable ou utilisable nécessitera de nombreuses étapes, parmi lesquelles ces quelques techniques exposées ci-après.
En analyse chimique et à plus grande échelle en métallurgie, on utilise parfois la précipitation sélective d’un solide afin d’isoler un cation d’un mélange en contenant plusieurs.
Il faut donc trouver l’anion qui précipite sélectivement un cation et pas l’autre ce qui dépendra du pH appelé pH de limite de précipitation.

L’électrolyse est une méthode très employée industriellement pour produire des métaux (zinc métallique…), des gaz (dichlore…), recouvrir des métaux (argent…), etc.
L’électrolyse est une transformation forcée par une énergie électrique transformée en énergie chimique.
Un générateur impose un sens au passage des électrons et peut provoquer des réactions d’oxydoréduction dites non spontanées. Autrement dit, le quotient de réaction s’éloigne de la constante d’équilibre de la transformation.
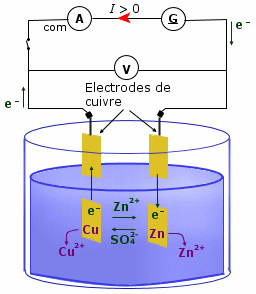
Le pôle positif de l’électrolyseur est l’électrode reliée au pôle positif du générateur c'est-à-dire l’électrode d’où partent les électrons donc là où l’oxydation a lieu. Il s’agit de l’anode.
Le pôle négatif de l’électrolyseur est l’électrode reliée au pôle négatif du générateur c'est-à-dire l’électrode d’où arrivent les électrons donc là où la réduction a lieu. Il s’agit de la cathode.
Les électrons circulent dans les fils
électriques mais en solution ce sont les ions
qui assurent le passage du courant. Ainsi, peuvent
participer aux échanges :
• les métaux des
électrodes ;
• les cations et anions de solutions
électrolytiques ;
• l’eau en tant
qu’espèce ampholyte (à la
fois oxydant et réducteur).

La formulation est un ensemble d’opérations qui permet de donner à une substance (aliment, boisson, cosmétique…) des propriétés qui en facilitent l’emploi et/ou la consommation (goût, odeur, solubilité, diminution des effets indésirables…).
Cette formulation peut consister en une couche protectrice, destinée à n’être dissoute qu’une fois le médicament dans l’intestin, ou encore donner un effet tampon au médicament. En effet, en solution, cette substance verra son pH varier très peu par dilution ou ajout de base et d’acide modérés.
L’utilisation d’un ion (sodium) ou d’un
autre (potassium) pour créer un savon dur (RCOO-+
Na+) ou mou (RCOO-+ K+), ne change rien au principe actif du
savon mais modifie ses
propriétés :
• un savon dur se déshydrate plus
vite et agira donc plus difficilement à froid ;
• un savon mou ne sèchera jamais et
deviendra mou et gélatineux.
Une partie importante du conditionnement dans nos aliments
concerne les conservateurs alimentaires qui
ont pour but, par des méthodes physiques ou
chimiques, d’éliminer ou
de ralentir le développement des
microbes.
La pasteurisation détruit les éléments pathogènes par chauffage à 100°C.
La stérilisation détruit les germes microbiens par chauffage à 140°C.
La congélation par abaissement rapide de la température à -22°C stoppe quasiment les dégradations des aliments.
La déshydratation (lyophilisation) revient à dessécher un aliment en retirant l’eau nécessaire aux réactions des germes pathogènes.
L’irradiation des aliments par action de
rayonnements ionisants issus
d’éléments radioactifs ou
d’accélérateurs de particules,
décompose partiellement les molécules des
micro-organismes.
Les conservateurs permettent de contrôler, voire d’empêcher le développement des micro-organismes. Ils sont repérés par la codification E200 à E297.
Certains bloquent le développement des levures, moisissures, comme par exemple, l’acide propanoïque dans le pain de mie. D’autres bloquent le développement des bactéries. Ceci est le cas du dioxyde de soufre dans de nombreuses boissons.
Les anti-oxygènes sont des réducteurs qui éliminent toute trace d’oxygène dans les aliments ce qui évite l’oxydation des jus de fruit, préserve la couleur de la viande, le rancissement des huiles, etc.
Leur code d’identification est E300.
Les matériaux sont très nombreux en ce qui concerne les emballages alimentaires mais la plupart pourront être qualifiés de solides, inaltérables, légers, et si possible, recyclables.
Parmi les plus utilisés, nous citerons le verre. C’est un mélange de silice (73%), d’oxyde de sodium, d’oxyde de calcium et d’alumine) dans lequel les premières « conserves » seront réalisées par stérilisation en 1795.
Les boîtes de conserve, en fer, acier ou encore aluminium datent de 1812, sauf les canettes qui datent de 1967. Elles sont intérieurement recouvertes de vernis hormis pour les fruits où l’étain joue le rôle d’anti-oxygène.
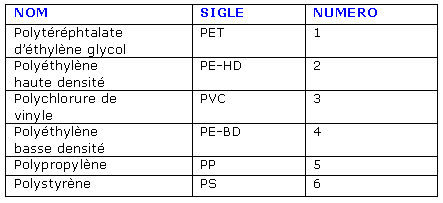
Les emballages plastiques, légers, faciles à former et à colorer sont peu altérables et sont synthétisés par polymérisation. On les repère par différents symboles :
Pour créer une substance, les techniques de synthèse sont très utiles mais pour élaborer un produit commercialisable, plusieurs étapes sont nécessaires :
• la séparation par précipitation fractionnée ou l’électrolyse par conversion d’énergie électrique en énergie chimique sont très utilisées pour isoler le produit désiré ;
• la formulation permet de modifier ce produit brut pour le rendre consommable, attrayant, etc ;
• le conditionnement dans un emballage adéquat avec des conditions de conservation précises permet le passage à la vente.
Toutes ces conditions seront pour chaque produit réunies au moindre coût et en essayant de respecter l’environnement.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !







