Principe de l'extraction par un solvant
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Tous les liquides ne se mélangent pas nécessairement : c’est le cas de l’huile et de l’eau même après agitation. Ces liquides sont dits non-miscibles (contrairement au vinaigre et à l’eau qui sont eux miscibles). Placé dans un récipient, le résultat de leur mélange sera observable (deux phases distinctes superposées, de nature hétérogène).
En classe de seconde, on travaillera toujours avec de
l’eau et une autre espèce
liquide (un solvant
organique comme le
dichlorométhane, le cyclohexane, ….). Pour une
extraction de type liquide-liquide, la
caractéristique qu’il convient de connaître
est la densité.
Cette grandeur (sans
unité) reflète la
capacité de l’espèce à flotter ou
à couler plus ou moins facilement dans
l’eau.

Une espèce chimique (soluté)
possède une faculté plus ou moins importante
(à cause de sa structure) à se mélanger avec
un liquide (solvant).
Le mélange du
soluté et du solvant formera une
solution.
Mais si une trop grande quantité de soluté est versée dans le solvant, ce dernier ne sera pas totalement dissout : on obtiendra une solution saturée. En chimie, cette limite est appelée solubilité : c’est la quantité maximum de soluté que l’on peut dissoudre dans un solvant donné.
Cette technique consiste à dissoudre une espèce donnée dans un solvant alors qu’elle est dissoute dans de l’eau (en classe de seconde).
• l’état physique du
solvant ; liquide
à température et pression de
l’extraction ;
• la non miscibilité du
solvant avec l’eau ;
• la solubilité de
l’espèce à extraire :
l’espèce extraite doit être plus soluble
dans le solvant que dans l’eau.
Il faut de surcroît connaître la densité du solvant pour connaître la position de la phase organique (qui contient le solvant) par rapport à la phase aqueuse (qui contient l’eau).
• mise en contact du solvant avec l’espèce
dissoute dans l’eau ;
• agitation puis décantation ;
• obtention de deux phases séparées : une
phase aqueuse et une phase
organique ;
• récupération la phase organique ;
• séchage (utilisation d’un agent
desséchant) puis filtration.
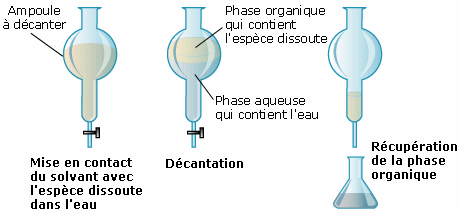
L’extraction par un solvant est une technique sélective qui repose sur la solubilité des espèces à extraire dans un solvant donné. Le solvant doit alors être non miscible à l’eau, dissoudre facilement l’espèce à extraire et être liquide à la température de l’extraction. Sa densité nous permet de situer la position de la phase organique pour achever l’extraction.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !







