Les différents rôles de l'électrolyse : purification, protection contre la corrosion, embellissement, récupération
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
On peut utiliser ce procédé pour purifier un métal comme le cuivre, pour protéger le fer contre la corrosion par électrozingage, pour embellir les pièces d’un service de couverts en les argentant ou encore pour récupérer une substance comme l’aluminium ou le dichlore.

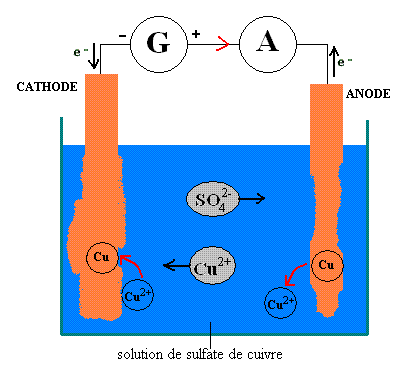

On parlera aussi d’un procédé de purification à anode soluble puisqu’elle a tendance à disparaître.

L’autre technique industrielle est la galvanisation réalisée par immersion de la pièce en acier dans un bain de zinc fondu.

L’alumine se décompose : Al2O3 = 2Al3+ + 3O2-.
Puis, l’aluminium se forme à la cathode : Al3+(aq) + 3e- = Al(s).
L’anode en carbone est consommée par la réaction anodique au cours duquel il se dégage du dioxyde de carbone : C + 2O2- = CO2 + 4e-.

L’électrolyse d’une solution de chlorure de sodium permet l’oxydation des ions chlorure qui se transforment en dichlore gazeux et la réduction de l’eau (couple H2O/HO-).
Il faut prendre des précautions car si le dichlore (Cl2) réagit avec la soude (ions hydroxydes présents), alors il y a production d’eau de Javel, c'est-à-dire d’un mélange d’ions hypochlorite et d’ions chlorure. On empêche donc cette réaction par récupération du dichlore au fur et à mesure de sa production.
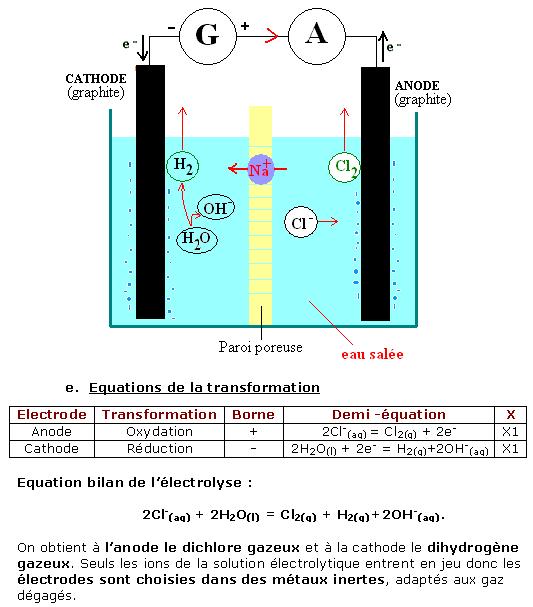
Il existe plusieurs procédés industriels pour réaliser cette électrolyse. Mais le procédé de la membrane qui sépare les deux compartiments anodiques et cathodiques en ne laissant passer que les cations sodium est le plus utilisé.
Le dichlore est utilisé dans la fabrication de nombreux produits intermédiaires notamment dans la production de PVC, dans la synthèse de médicaments ou de produits phytosanitaires.
Toutes ces phases de purification, de protection, d’embellissement ou de récupération sont utilisées à des échelles industrielles et permettent de séparer de nombreux constituants pour les utiliser dans différents autres produits.
On peut différencier les procédés à anode soluble, ceux de recouvrement cathodique et les derniers à électrodes inertes.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !







