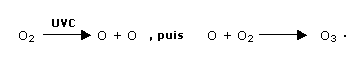L'ozone
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Les gaz sont répartis de façon homogène dans l'atmosphère, sauf l'ozone essentiellement présente dans la stratosphère.
Quelles sont ses particularités ?
Le dioxygène est apparu vers –2 Ga et a progressivement entraîné l'apparition d'une couche d'ozone (O3) devenue importante vers –0,6 Ga.
L'ozone se forme dans la stratosphère
à partir du dioxygène et sous l'action de la
lumière.
Une molécule de dioxygène se dissocie sous
l'action des rayons solaires ultraviolets de haute
énergie (UVC), les deux atomes d'oxygène se
combinent alors chacun à une molécule de
dioxygène pour former l'ozone.
|
|
|
Doc. 1. Réaction de formation de l'ozone. |
La réaction de formation de l'ozone peut être
réversible sous l'action d'une autre catégorie
d'ultraviolets, les UVB, et redonner ainsi du
dioxygène et un atome d'oxygène.
La teneur stable en ozone de l'atmosphère
résulte ainsi d'un équilibre dynamique entre
formation et destruction.
Le rôle majeur de l'ozone est
d'absorber les ultraviolets solaires. Ainsi,
les UVC sont rapidement absorbés dans la
stratosphère par les molécules de
dioxygène, contribuant à la formation
d'ozone.
Dans la troposphère, les molécules d'ozone vont
absorber les UVB et être alors détruites. Seuls
les UVA parviennent à la surface du globe.
L'ozone a donc contribué directement à la conquête du milieu terrestre par les êtres vivants et sa présence dans l'atmosphère conditionne le maintien de cette vie aérienne.
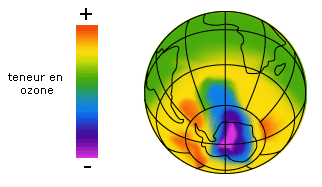
Depuis quelques années, les médias parlent régulièrement du trou dans la couche d'ozone.
|
|
|
Doc. 2. Schéma tiré d'une image satellitale d'octobre 1996. |
L'origine de cette diminution de la teneur en ozone de la
stratosphère, observable sur des images satellitales,
est à la fois naturelle et liée aux
activités humaines. L' acteur principal de cette
destruction est l'atome de chlore qui
détruit la molécule d'ozone selon la
réaction :
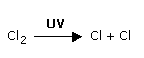
Par la suite, la molécule de chlore est
reconstituée par la réaction :
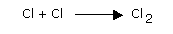
Le dichlore est naturellement présent dans
l'atmosphère, car il est libéré par des
algues marines. Cependant, l'utilisation par l'Homme ces
dernières années des CFC
(chlorofluorocarbone) a augmenté sa
teneur atmosphérique.
Longtemps, les CFC ont été utilisés dans
les bombes d'aérosols et comme
réfrigérants ou solvants. Propulsés dans
la stratosphère, les CFC ont libéré leur
chlore sous l'action des UV. Ces molécules se sont
ensuite progressivement associées à d'autres
molécules formant ainsi des composés
chlorés stables, réservoirs de chlore.
La présence de ces réservoirs de chlore conduit
à une importante destruction de l'ozone sur une
zone particulière du globe, à une période
donnée de l'année.
Les phénomènes météorologiques se
déroulant en Antarctique au début du printemps
conduisent, en effet, à la libération de
molécules de dichlore qui, sous l'action des UV,
génèrent du chlore, Cl, entraînant une
accélération de la destruction de l'ozone.
La prise de conscience de ces phénomènes ont conduit l'Homme à diminuer son utilisation des CFC, notamment dans les aérosols, afin de limiter la destruction de l'ozone, gaz indispensable au maintien de la vie à la surface du globe.
L'ozone, formé à partir du dioxygène, joue un rôle majeur dans le développement et le maintien d'une vie aérienne en absorbant les ultraviolets solaires, agents mutagènes puissants.
De part ses activités, l'Homme a influé sur la teneur en ozone et par conséquent sur son environnement. Ces prises de conscience ont entraîné la mise en place de mesures visant à protéger l'environnement.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !