L'évolution du modèle de l'atome de l'Antiquité à nos jours
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
De l'Antiquité à nos jours, de grands physiciens et chimistes ont étudié le constituant universel de toute chose : l'atome.
Mais pour Aristote (384 - 322
av. J.-C.), la matière peut être divisée et
résulte de la combinaison de quatre
éléments : l'eau, l'air, le
feu et la terre.
A défaut de preuve expérimentale, les idées
émises par Démocrite restent, à cette
époque, purement philosophiques.
D'ailleurs l'alchimie, au Moyen-Age, se développe sans se préoccuper des conceptions atomistiques des grecs.
John Dalton (1766 - 1844), scientifique anglais, est le premier à poser les bases scientifiques de la théorie ébauchée par Démocrite. Elles sont au nombre de cinq :
- Toute matière est constituée
d'atomes.
- Les atomes d'un
« élément » sont
identiques.
- Les atomes d'éléments différents ont des
masses différentes.
- Un composé est un mélange
spécifique d'atomes d'un ou de plusieurs
éléments.
- Lors d'une réaction chimique, les atomes ne sont ni créés ni détruits mais se réarrangent pour donner de nouveaux composés.
Pour visualiser ces concepts, il symbolise les différents atomes à l'aide de schémas :

J.J. Thomson (1871 - 1937) découvre que les rayons émis par une cathode métallique, quel qu'en soit le métal, dans un tube de Crookes (identique à celui des téléviseurs dans lequel le vide a été fait), sont constitués de particules chargées négativement qu'il appelle « électrons » : il en déduit que c'est un élément constitutif de l'atome.
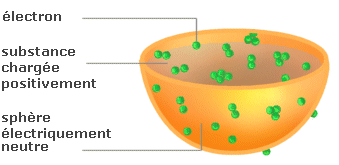
Il imagine, en 1902, un modèle de
l'atome :
une sphère électriquement neutre remplie
d'une substance chargée positivement dans laquelle
les électrons sont figés :
Pour prouver l'existence du noyau, Rutherford bombarde une feuille d'or de 0,1 μm d'épaisseur avec un faisceau de particules α positives et observe que certaines rebondissent anormalement.
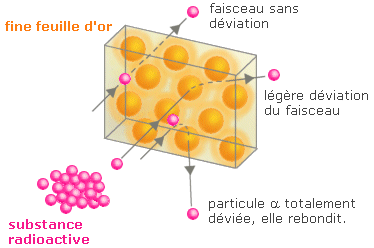
Rutherford conclue donc à l'existence de particules chargées positivement dans l'atome d'or qui repoussent les particules α. Ces particules sont confinées dans une petite partie de l'atome appelée « noyau ».
Le modèle du système solaire est alors adopté : le noyau central est associé au Soleil, et les électrons gravitant autour, aux planètes.
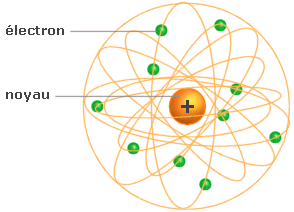
Mais au 20e siècle, ce modèle couramment
utilisé est déclaré faux avec
l'avancée de la physique quantique.
N.
Bohr, W.
Pauli et E.
Schrödinger établissent que le noyau
est entouré d'un « nuage
d'électrons » plus ou moins dense selon la
probabilité de présence de ces derniers.
Mais pour l'étude de l'atome et de ses propriétés, il est plus aisé de conserver le principe d'un nuage électronique composé d'orbitales ou couches électroniques sur lesquelles gravitent les électrons.
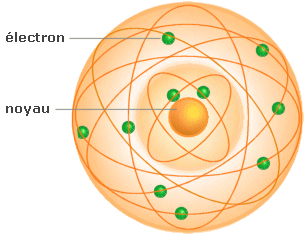
De nos jours les quarks qui constituent les nucléons sont encore à l'étude.
La matière était, dans l'Antiquité, considérée comme le mélange des quatre éléments fondamentaux : l'air, l'eau, la terre et le feu, mais dès cette époque Démocrite propose l'existence d'« atomes » indivisibles à la base de toute chose.
Ces théories seront abandonnées jusqu'à ce
que Dalton propose l'existence d'une série d'atomes
expliquant les réactions chimiques.
Thomson met en évidence l'existence de charges
négatives appelées
« électrons » et Rutherford
l'existence de charges positives, dans l'atome
électriquement neutre.
Ainsi le modèle de l'atome a pu voir le jour au 19e siècle : l'atome est constitué d'un noyau central, chargé positivement, et d'électrons, chargés négativement, qui gravitent autour dans le nuage électronique.
Puis le nuage électronique, dont Pauli pensait qu'il était constitué d'orbitales sur lesquelles se répartissaient les électrons, a été redéfini par Schrödinger qui le décrivit comme un nuage aux densités différentes selon la proximité du noyau.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !







