Comment utiliser la classification périodique des éléments
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
La classification actuelle classe les éléments
chimiques par numéro atomique croissant de manière
à ce que chaque ligne corresponde au remplissage d’une
nouvelle couche électronique et que les éléments
d’une même colonne possèdent le même nombre
d’électrons périphériques.

2. Formation d’un ion monoatomique
D’après les données précédentes, les éléments d’une famille (colonne du tableau périodique) ont tous le même nombre d’électrons périphériques. De manière à respecter les règles du duet et de l’octet :
-
Les
atomes qui ont moins de 4 électrons sur leur couche
externe, soient les éléments
des 3 premières colonnes du tableau des 18 premiers
éléments, auront tendance à les perdre afin de
former un ion.
-
Les
atomes qui ont plus de 4 électrons sur leur couche
externe, soient les éléments
des 3 dernières colonnes du tableau des 18 premiers
éléments, cherchent à gagner le nombre
d’électrons nécessaire de manière à
adopter la structure électronique du gaz rare qui leur est
le plus proche.
- Pour les atomes de la 4ème colonne du tableau des 18 premiers éléments, on comprend bien qu’ils sont partagés entre le fait de vouloir gagner 4 électrons ou d’en perdre 4 : la formation d’ions à partir de ces atomes est donc très rare !
On notera cet ion : Mg2+. Notons que les atomes de la même famille donnent tous des ions du type X2+ (les atomes perdent 2 électrons, ils donnent des ions positifs).
De même que la formation d’ions, la formation de liaisons covalentes permet à un atome de respecter la règle du duet ou de l’octet.
La formation d’une liaison implique l’emprunt d’un électron par un atome à un autre atome auquel il va se lier. Ce qui signifie qu’un atome réalise autant de liaisons qu’il a besoin d’électrons pour adopter une structure électronique stable.
On peut donc conclure que les atomes situés dans les colonnes 4, 5, 6, 7 du tableau des 18 premiers éléments cherchent à réaliser respectivement 4, 3, 2, 1 liaison covalentes.
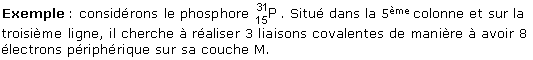
Illustration animée : La classification périodique
Voici une classification périodique complète. Elle permet à la fois de connaître les caractéristiques de chaque atome, mais aussi son appartenance à des groupes particuliers.
- Tableau 1
- Tableau 2

- Tableau 3

- Tableau 4

Une ligne du tableau périodique correspond au remplissage d’une couche électronique alors qu’une colonne indique le nombre d’électrons situé sur cette couche (électrons périphériques).
Afin de tendre vers la structure électronique du gaz rare qui lui est le plus proche, un atome va perdre ou gagner des électrons afin de former des ions ; ou va contracter des liaisons covalentes avec d’autres atomes et former des molécules.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !







