Lois sur les gaz
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
La société a développé des lois qui lui permettent de contrôler et de guider la population. La sévérité de ces lois varie selon le pays et le type de régime politique. Par exemple, une loi de votre pays vous oblige à payer des taxes et des impôts.
La nature possède elle aussi ses propres lois, lesquelles régissent les divers phénomènes physiques ou chimiques. La grande différence entre les lois naturelles, c'est-à-dire celles de la nature, et les lois artificielles, c'est-à-dire celles créées par les êtres humains, est leur rigidité.
En effet, les lois naturelles ne peuvent être contournées, tandis que celles de la société servent plutôt de guides pour juger, de façon officielle, les actes des individus.
Les lois des gaz sont immuables, c'est-à-dire qu'elles ne sont pas sujettes à changement. Par exemple, une de ces lois stipule qu'un gaz, dans un vase clos, exerce une pression égale sur tous les points des parois ; cette loi est toujours vraie, peu importe le lieu et le temps où elle est vérifiée.
Dans cette étude, vous étudierez les différentes lois qui régissent le comportement des gaz.
L'étude nommée propriétés des gaz, vous apprend que l'air a une masse donc un poids. Vous savez aussi que les liquides, en vertu de la pesanteur, exercent une pression sur les corps qui y sont immergés. De même, l'air constituant l'atmosphère, dont le poids est considérable, crée une pression sur le sol et sur les corps placés dans cette atmosphère.
Les être humains et les animaux qui habitent cet océan d'air n'ont aucune conscience de la présence de la pression atmosphérique, puisqu'elle s'exerce de façon égale sur toutes les faces du corps, y compris à l'intérieur ; la pression est donc équilibrée en tous sens.
L'unité de base définie
pour la pression dans le système international d'unités
est le pascal (Pa) et newton (N). Toutefois, une
pression de 1 Pa 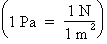 est en
fait une pression trop faible pour que notre sens du toucher
puisse la percevoir. La plupart du temps, on utilise donc
ses multiples, le kilopascal (kPa) et le mégapascal
(MPa).
est en
fait une pression trop faible pour que notre sens du toucher
puisse la percevoir. La plupart du temps, on utilise donc
ses multiples, le kilopascal (kPa) et le mégapascal
(MPa).
La plupart des pressions sont indiquées par rapport à une pression de référence, soit la pression atmosphérique.
Toutefois, la pression atmosphérique varie selon le lieu et les conditions atmosphériques, au niveau de la mer, entre 98 et 104 kPa. En général, elle demeure assez stable à 101 kPa, comme on peut le constater tous les jours à la rubrique météo.
Dans la pratique courante, on utilise souvent une autre unité, appelée "bar", en raison de sa correspondance approximative avec la pression atmosphérique (patm).
1 bar = 100 kPa
Sachez que lorsqu'on parle de pression, il vaut mieux estimer un ordre de grandeur plutôt que d'axer sur la précision. En ce sens, retenez les relations suivantes : patm = environ 1 bar = environ 100 kPa
La pression absolue, dans un fluide, est la pression réelle de ce fluide, c'est-à-dire la pression qui règne dans l'ensemble de ses molécules. Par exemple, l'air que nous respirons a une pression absolue d'environ p = 1,01 bar.
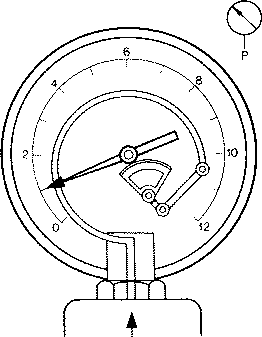
Lorsque l'on mesure la pression d'un fluide enfermé dans un vase clos à l'aide d'un manomètre comme celui de la figure suivante, on obtient la pression effective de ce fluide, c'est-à-dire la valeur de sa pression sans tenir compte de la pression atmosphérique.
On mesure donc l'excédent de pression par rapport à la pression atmosphérique. En effet, le manomètre subit dès le départ la pression atmosphérique.
Toutes les lectures que vous faites au cours de vos expériences de travail traduisent donc des pressions effectives. Une pression effective de 500 kPa (5 bars) est donc une pression supérieure de 500 kPa à la pression atmosphérique.
Manomètre :
Pour connaître la pression absolue d'un fluide enfermé dans un vase clos, on doit additionner, à la pression effective, la valeur de la pression atmosphérique normale, soit environ 1 bar ou 100 kPa. Une pression effective de 500 kPa équivaut donc à une pression absolue de 600 kPa.

On appelle
aussi la pression effective "pression relative" du fait qu'on
obtient une lecture par rapport à la pression
atmosphérique. En anglais, on dit aussi une pression
gauge.
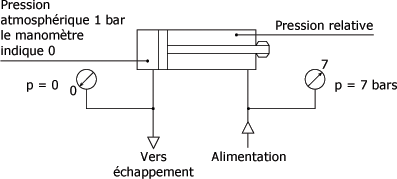
Le vérin à double effet figure suivante fonctionne avec une pression de 7 bars. C'est la pression lue au manomètre, appelée pression relative. Avant l'admission d'air les chambres du vérin étaient à la pression atmosphérique par l'échappement soit 1 bar. Le manomètre indique 0. La pression absolue est égale à 7 + 1 = 8 bars.
Pressions :
Pression vacuum :
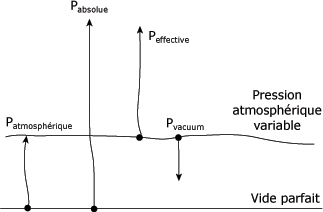
A l'inverse d'un compresseur qui comprime de l'air sous pression, on obtient une pression négative par rapport à la pression atmosphérique lorsqu'on tente de faire le vide dans un vase clos. Cette pression négative est désignée par l'expression "pression vacuum".
L'échelle de la pression vacuum fonctionne à l'inverse des autres, car elle tend vers le vide parfait. La pression vacuum maximale est donc la pression atmosphérique, et la pression la plus faible, le vide absolu (0 Pa). En pratique, il est techniquement impossible qu'une pompe vacuum atteigne le vide parfait à cause des fuites.
On identifie les manomètres à pression négative à l'aide de l'abréviation "VAC". Comme la gamme des pressions négatives est restreinte, on fait davantage appel à d'autres unités de mesure que le Pa pour obtenir plus de précision. Les valeurs entre parenthèses correspondent à la pression négative maximale, soit la pression atmosphérique :
- pascals (101 000 Pa) ;
- mètres d'eau (10,33 m) ;
- centimètres de mercure (76 cm Hg).
La figure suivante permet de comparer les différentes échelles de pression par rapport au vide et à la pression atmosphérique.
Comparaison des pressions :
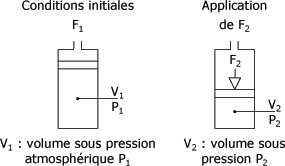
"A température constante, le volume occupé par une masse donnée de gaz varie en raison inverse de la pression qu'elle supporte." On peut écrire cette relation sous la forme de l'équation suivante : p1V1 = p2V2 = Constante
Au départ, conditions initiales, le volume d'air V1(V1 = 1) d'un cylindre est à la pression p1, pression atmosphérique, sous l'action de la force F1. Si l'on comprime le volume d'air V1 sous l'action de la force F2, pour obtenir un volume V2, moitié de V1, la pression p2 aura doublé. La figure 1.5 montre ces variations.
Variations de p en fonction de V :
Hypothèses :
1 atm = 1,013 bar ;
p1 = 1 bar pour V1 = 1 ;
p2 = ? pour V2 =
=
.
Valeur de p2
p1 V1 = p2 V2
p2 =
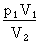
p2 =
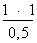
p2 = 2 bars = 2 atm
L'atmosphère (atm) est une unité de mesure de pression valant pproximativement 1,01 bar, 101 kPa.
Il est à noter que les valeurs de pression utilisées avec cette équation sont des pressions absolues (pression effective + pression atmosphérique).
A la suite de cet exemple, on peut énoncer qu'à température constante, le volume occupé par un gaz passe de V1 à V2, à V3, etc. quand la pression qu'il subit passe de p1 à p2, à p3, etc.
Loi de Gay-Lussac :
A pression constante, le volume d'une masse invariable de gaz est proportionnel à sa température absolue.
= Constante -
=
.
Loi de Charles :
A volume constant, la pression d'une masse invariable de gaz est proportionnelle à sa température absolue.
= Constante -
=
.
La dilatation des corps est l'un des effets de la chaleur, conséquence immédiate de l'élévation de la température. L'observation montre en effet que le plus souvent, lorsqu'on chauffe un gaz, son volume augmente ; on dit qu'il se dilate, et ce phénomène est appelé dilatation.
La dilatation s'explique par l'amplitude de l'agitation moléculaire : plus la température s'élève, plus les molécules s'agitent et s'éloignent, l'agitation moléculaire étant à la base de la théorie de la chaleur. La contraction, par contre, est due à l'abaissement de la température, qui entraîne une diminution du mouvement moléculaire.
"Le coefficient de dilatation cubique d'un gaz est l'accroissement du volume que subit l'unité de volume de ce gaz pour une élévation de température de un degré." On peut déterminer la valeur du coefficient de dilatation cubique d'un gaz à l'aide de l'équation suivante :
K =
dans laquelle :
K représente le coefficient de dilatation cubique d'un corps :
V2 est le volume du corps à la température T2 (température absolue) ;
V1 est le volume du même corps à la température T1 (température absolue).
Comme le montre la figure suivante, on peut construire un appareil pour mesurer les variations de volume d'un gaz dues aux variations de température, et ce, sous pression atmosphérique au moment des mesures de volume. Le cylindre, dont le volume est connu, possède un piston qui peut glisser sans frottement appréciable.
Appareil de mesure :
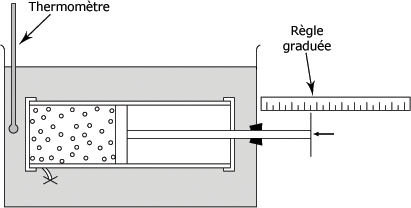
On plonge le cylindre rempli d'air dans un bain de glace fondante température t0 (0°C) ;
On repère alors la position du piston sur la règle et on détermine le volume V0 occupé par l'air à la température de 0°C et sous pression atmosphérique.
On élève ensuite la température du bain à t1 et on note la nouvelle position du piston. On détermine ainsi le volume V occupé par l'air, à la température t1, sous la même pression atmosphérique.
Le volume d'air à la température de 0°C (t0) étant V0 :
- la dilatation globale est égale à V - V0 ;
- la dilatation par unité de volume vaut
;
- la dilatation par unité de volume pour une élévation de température de 1°C devient
=
, c'est le coefficient
(alpha) de dilatation sous pression constante (t = élévation de température en°C). On appelle aussi le coefficient de dilatation "coefficient d'expansion volumique".
Le coefficient est le même pour tous les gaz : il vaut 1/273. Il existe aussi un coefficient ß (bêta) pour l'augmentation de la pression à volume constant. Ce coefficient de pression a la même valeur que celui d'expansion volumique, soit 1/273.
Zéro absolu :
Puisque le volume d'un gaz à 0°C, maintenu à pression constante, varie de 1/273 pour chaque variation de 1°C, si l'on refroidit fortement le gaz, le volume devrait diminuer au point de devenir nul lorsqu'on atteindra la température de - 273°C.
La température de - 273°C est vraiment la limite la plus basse qu'il soit possible d'imaginer, de laquelle on ne se rapproche que très difficilement. La température de - 273°C est appelée zéro absolu. Si la température t d'un gaz est donnée en degrés Celsius, la température absolue T de ce corps est déterminée en ajoutant 273.
T = t (°C) + 273.
L'unité degré Celsius est égale à l'unité kelvin : 1°C = 1 K. La figure suivante vous présente l'échelle des températures en kelvins et en degrés Celsius.
Échelle des températures en kelvins et en degrés Celsius :
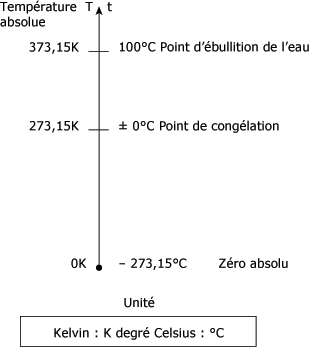
Il est d'usage de remplacer le T par K et d'exprimer la température absolue en kelvins : K = t + 273.
Il est nécessaire de convertir la température en kelvins lorsque vous avez à résoudre un problème où l'inconnue est la pression ou le volume.
La relation entre la pression et la
température d'un gaz maintenu à volume constant
s'exprime comme suit : 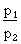 =
= 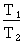 .
.
De même, la relation entre le volume et la température d'un gaz maintenu à pression constante est la suivante :
=
.
Ce qui donne, comme équation générale :
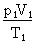 =
= 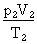 = Constante
= Constante
"Toute pression exercée sur un fluide enfermé dans un vase clos est transmise intégralement à tous les points du fluide et des parois."
On sait que, contrairement aux liquides, les gaz sont compressibles. Toutefois, pour une pression donnée à l'intérieur d'un vase clos, que ce soit pour un liquide ou un gaz, cette pression est égale et s'exerce intégralement sur tous les points des parois, la force de pression étant perpendiculaire à la paroi.
Comme vous pouvez le voir à la figure suivante, l'air emprisonné dans un réservoir à une pression donnée transmet cette pression à un système pneumatique considéré comme étant étanche, donc un vase clos. Le principe de Pascal s'applique à tous les points des conduits et des composants du système pneumatique.
Système pneumatique :
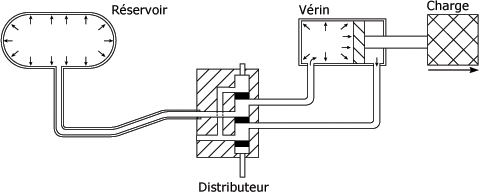
Application de la transmission des pressions :
Généralement, les systèmes pneumatiques fonctionnent avec une pression effective (relative) de 1 000 kPa soit 10 bars maxi. La charge à déplacer est généralement connue, car on construit un système en fonction d'un travail à faire.
Dans un vérin, la pression exercée sur la surface du piston crée une force qui est le résultat du produit de la pression (p) du système par la surface (S) du piston.
On peut donc écrire la relation
suivante : F = p 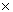 S
S
Les unités utilisées pour appliquer cette formule sont les suivantes dans le système international d'unités (SI) :
- Force (F) : en newton (N) ;
- Pression (p) : en pascal (Pa) ;
- Surface (S) : en mètre carré (m2).
Pour déterminer la force nécessaire pour déplacer une charge à l'aide d'un vérin, on doit connaître deux des trois paramètres de la formule.
Exemple
Problème
Un vérin à double effet est alimenté par une pression (p) de 8 bars (800 kPa). Le mouvement de sortie de la tige du vérin commande le déplacement d'une charge. La force (F) nécessaire pour ce travail est de 6280 N. Déterminer le diamètre du vérin. Le tableau figure suivante présente le développement en utilisant la relation entre les unités.
Calcul du diamètre du vérin :

Une masse (m) s'exprime en kilogramme (kg) et est indépendante de l'accélération de la pesanteur.
Au contraire, un poids (P) ou une force (F) s'exprime en newton (N).
La force de pesanteur, appelée poids se définit par la relation :
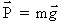
= P : poids du corps (N).
m : masse du corps (kg).
= g : accélération de la pesanteur (m/s2).
Débit :
En pneumatique, l'air provient généralement d'un réservoir sous pression ou directement du compresseur. Cet air circule dans des conduits après que sa pression a été maintenue constante en le faisant passer par un régulateur de pression.
Les fabricants de composants pneumatiques fournissent des abaques qui permettent de déterminer le débit d'air d'un système en fonction du diamètre des conduits et de la pression de service.
En résumé sur les lois sur les gaz :
- La pression atmosphérique s'exerce sur toutes les faces des corps, y compris à l'intérieur.
- La pression atmosphérique au niveau de la mer est d'environ 100 kPa ou 1 bar.
- La pression absolue est la pression lue sur un manomètre (pression effective ou relative) plus la pression atmosphérique.
- Une pression effective négative correspond à une pression vacuum.
- A la température constante, le volume occupé par une masse donnée de gaz varie en raison inverse de la pression qu'elle supporte.
- Dans la formule p1V1 = p2V2, la pression utilisée est la pression absolue.
- La dilatation et la contraction des gaz sont dues respectivement à l'augmentation et à la diminution de la température.
- Le zéro absolu a une valeur de - 273°C et son symbole est K, pour kelvin.
- La pression exercée sur un fluide enfermé dans un vase clos est transmise intégralement à tous les points du fluide et des parois.
- La force théorique (F) développée par un vérin dépend de la pression p (manométrique) et de la surface (S) du piston (F = p
S).
- Le diamètre du conduit et la pression de service influencent directement le débit d'air dans ce conduit.
Vous connaissez maintenant les lois fondamentales qui régissent le comportement des gaz. Une étude traite de l'utilisation de l'air.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








