Applications à des titrages mettant en jeu des réactions d'oxydoréduction
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Dans le cas des réactions d’oxydoréduction, de nombreuses méthodes peuvent être mises en place :
• titrage direct colorimétrique ;
• titrage indirect d’un excès de titrant.
Toutes ces méthodes seront exploitées, les équations et calculs détaillés pour déterminer dans chaque cas la concentration de la solution inconnue X.
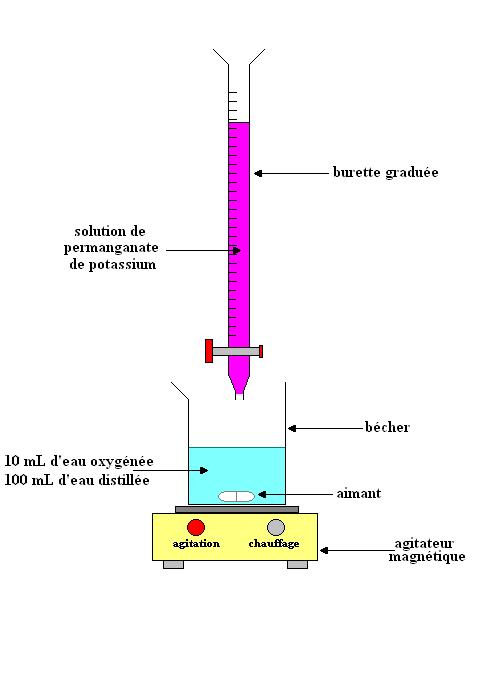
On veut déterminer la concentration en
peroxyde d’hydrogène
H2O2 d’une solution
commerciale d’eau oxygénée à
10 volumes.
Pour cela, on dose une prise de 10 mL (après avoir
dilué 10 fois la solution commerciale) par une
solution titrante de permanganate de potassium K+ +
MnO4- de concentration
connue Ct = 0,020
mol.L-1.
Lors d’un titrage direct, la solution à doser, l'eau oxygénée, est placée dans un bécher que l’on fait réagir avec une solution de concentration connue appelée réactif titrant placé dans une burette graduée. Il s'agit de la solution d’ions permanganate.


On place un volume connu de jus de citron
pressé, contenant de la vitamine
C, X, dont on cherche la
concentration dans
l’échantillon,. On filtre ensuite la
solution (pas de pulpe) en présence d’une grande
quantité de diiode en excès,
Ti.
Le diiode, n’ayant pas réagi avec
la vitamine C , Texcès , est
titrée par une solution d'ions
thiosulfate, R, de concentration connue, en
présence d’empois d’amidon pour un passage
à l’équivalence plus visible.
Ces deux transformations,
totales, rapides et
uniques, se succèdent mais le titrage
n’a lieu que pour la seconde d’où le terme
de titrage « indirect ».
Il reste alors à soustraire à la totalité introduite Ti, la quantité Texcès titrée par R pour trouver la quantité de matière Tr de solution de diiode qui a réagi avec la vitamine C, X, et en déterminer la concentration.
On lave la burette à l’eau puis on la rince et on la remplit avec la solution de thiosulfate de sodium de concentration connue jusqu’au passage du violet à l’incolore pour obtenir le volume équivalent V’eq.

Pour déterminer nX, il faut
déterminer la quantité
nTr de diiode ayant réagi
car les deux quantités de matière sont
liées par la relation issue de
l’équation-bilan (1) :
n[I2(aq)] ou
nTr =
nC6H8O6(aq).
On détermine nTr grâce
à la différence :
n(I2)ou nTi
= nI2(aq) ou nTr ayant
réagit avec X +
n[I2(aq)] ou
nTexcès ayant réagi
avec R.
n[I2(aq)] ou nTr = n(I2) ou nTi - n[I2(aq)] ou nTexcès = nC6H8O6(aq).
Le titrage par le thiosulfate (R) permet de
déterminer n[I2(aq)] ou
nTexcès par la relation
d’équivalence de l’équation-bilan
(2) :
n[I2(aq)] ou
nTexcès =
nS2O32-/2.
D’où nC6H8O6(aq) = n(I2)ou nTi - nS2O32-/2.
Les différentes applications des titrages d’oxydoréduction sont nombreuses et concernent des produits courants. Mais elles sont pour la plupart basées sur des titrages colorimétriques, directs ou indirects, et peu sur des mesures physiques servant à tracer une courbe à exploiter.
Pour déterminer les concentrations des espèces à titrer, on peut utiliser le tableau d’avancement ou les relations de proportionnalité issues des proportions stoechiométriques de l’équation-bilan ou des demi-équations dans le cas des titrages indirects.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !







