Les différentes formulations de l'aspirine et du paracétamol
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Les différentes formulations de l’aspirine et du paracétamol sont proches car ces deux molécules ont les mêmes cibles organiques.
L’aspirine ou acide
acétylsalicylique possède des
propriétés antiseptiques,
antalgiques,
antipyrétique (combat la
fièvre), anti-inflammatoire et anti-aggrégante
(retarde la coagulation sanguine).
Le terme aspirine, déposé par Bayer (1899), se
décompose ainsi : A pour
acétylation, spir pour spirée,
qui est le nom scientifique de la reine-des-prés et
ine, suffixe classiquement utilisé par
les chimistes.
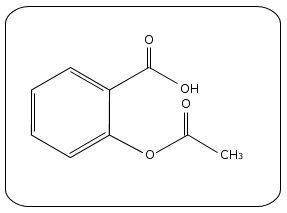
On peut remarquer la présence de deux groupes
caractéristiques : le groupe
carboxyle et le groupe ester.
L’aspirine est insoluble dans l’eau
à 25°C par contre elle peut être
assimilée dans l’estomac à pH =
2 par les lipides ou dans l’intestin
à pH = 8 par dissolution en phase
aqueuse.
En effet le pKA du couple acide acétylsalicylique / ion
acétylsalicylate est :
pKA (C9H8O4/
C9H7O4-) = 3,5.
D’où le diagramme de
prédominance :
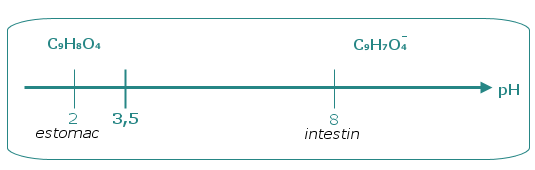
La forme acide du couple C9H8O4 est liposoluble et présente peu d’affinités avec l’eau tandis que la forme basique C9H7O4- peut facilement former des liaisons hydrogène avec les molécules d’eau donc peut être qualifiée d’hydrosoluble.
L’aspirine est, dans les conditions décrites ci-dessus, hydrolysée en acide salicylique. Mais pour être efficace, la dose initiale doit être parfaitement déterminée pour être active en quantité suffisante au niveau des récepteurs de l’organe visé, sans réactions parasites.
Le principal problème de l’acide
salicylique obtenu est qu’il provoque des
brûlures d’estomac donc il faut
limiter le contact entre la muqueuse de
l’estomac et l’aspirine.
L'aspirine a des effets analgésiques en
partie parce qu'elle inactive une enzyme, la
cyclooxygénase et ainsi freine la
synthèse des prostaglandines. Ceci
empêche leur accumulation dans les tissus
et réduit très fortement la
réaction inflammatoire.
C'est aussi l'action anti-prostaglandines qui
explique les effets secondaires de l'aspirine
sur la muqueuse gastrique : les
prostaglandines diminuent normalement la production d'acide par
la muqueuse gastrique et stimulent la production de mucus qui
protège les cellules. L'aspirine,
en bloquant ces processus, fait que les
cellules gastriques sont attaquées par l'acide
gastrique (toxicité digestive).
Les différentes formulations
disponibles en pharmacie pallient à ces
différents problèmes.
Ainsi la dissolution ne se fait qu’en solution aqueuse, une fois l’enveloppe protectrice dissoute. Le pH de la solution obtenue est 6,8 donc la forme basique C9H7O4- est présente et peut réagir avec l’eau.
On parle d’aspirine tamponnée car une fois dissoute, l’ajout modéré de base ou d’acide ainsi que la dilution n’auront que peu d’effet sur son pH.

L’acétylsalicylate de lysine a
pour formule :
CH3CO2-C6H4-CO2-
+
+NH3-(CH2)4-CH(NH3+)-CO2-.
Cette molécule est hydrosoluble, c’est-à-dire facilement solubilisée dans l’eau, car le pH de la solution obtenue est de 6,5. Le principe actif C9H7O4- sera donc libéré.
L’aspirine effervescente contient des ions hydrogénocarbonate HCO3- appartenant au couple pKA (CO2, H2O / HCO3-) = 6,4 à 25°C qui libèrent donc du dioxyde de carbone en réagissant avec la forme acide du couple de l’aspirine :
C9H8O4 + HCO3- → CO2, H2O + C9H7O4-.
Ainsi l’acétylsalicylate peut être solubilisé dans l’eau.
On peut vérifier que le dioxyde de carbone est bien le gaz formé grâce au test à l’eau de chaux qui se troublera.
Le paracétamol a une activité
analgésique et antipyrétique
d'intensité comparable à celle de l'aspirine mais
elle n'a pratiquement pas d'effet sur
l'inflammation.
Il n'a pas les effets secondaires de
l'aspirine, il ne provoque pas de lésion de la
muqueuse gastrique et n'interfère pas avec
l'aggrégation plaquettaire.
Le nom paracétamol vient de la contraction de
para-acetyl-amino-phenol.
C’est un solide blanc, peu soluble dans
l’eau à 25°C, qui fond à 168 °C et
peut être synthétisé
à partir d’anhydride éthanoïque et de
para-aminophénol pour donner la molécule
suivante :
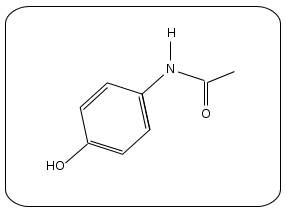
La molécule C8H9NO2 de paracétamol présente deux groupes caractéristiques : la fonction alcool et la fonction amide.
Le principal conditionnement concerne la solubilité faible dans l’eau du paracétamol.
Le but est de soulager en donnant de l’énergie, cette formulation a un but médical et marketing.
Il existe d’autres adjuvants ayant des propriétés antioxydantes : Cystéine et azote.
La solubilité peut être augmentée par adjonction de co-solvants ou par modification du pH : on ajoute du mannitol pour solubiliser et rendre isotonique la solution obtenue.
Le tampon phosphate permet de prévenir l’hydrolyse en p-aminophénol.
Comme pour l’aspirine le paracétamol sera hydrolysé par l’organisme pour agir.
Tous les médicaments en vente en pharmacie sont formulés et conditionnés pour être commercialisables.
Ces étapes sont importantes et nécessaires pour le patient qui ne pourrait correctement assimiler ces médicaments.
Le conditionnement se fait par ajout de solutions ou d’espèces ne modifiant pas les propriétés intrinsèques du médicament.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !







