Les piles et les accumulateurs
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
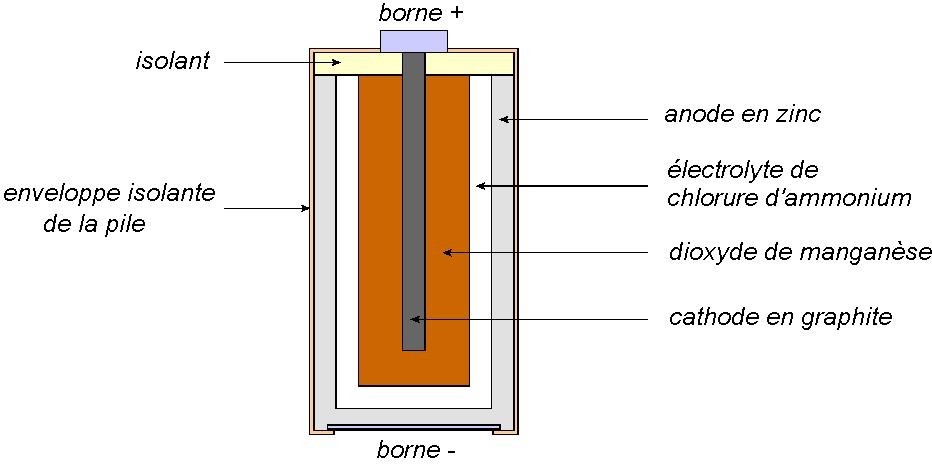
Comme pour la pile Daniell, l’anode est en zinc. Durant le fonctionnement de la pile, le zinc s’oxyde selon la demi-équation électronique :
Les électrons sont libérés dans le circuit électrique par la borne – qui est reliée électriquement au zinc.
L’électrolyte est du chlorure d’ammonium
Du côté de la cathode, on a réduction du dioxyde de manganèse
Les électrons sont aspirés du circuit électrique par l’intermédiaire de la borne + et de l’électrode en graphite, électriquement conductrice.
La réaction globale qui se produit dans la pile s’obtient avec les deux demi-équations :
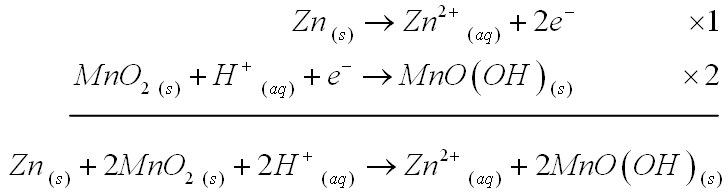
La force électromotrice E d’une pile saline est de 1,5 V environ. Afin de rendre l’électrolyte plus conducteur, on y rajoute des particules de carbone. Dans certaines piles, le dioxyde de manganèse et l’électrolyte sont mélangés. La résistance interne d’une pile neuve n’est que de quelques ohms. Cependant, à mesure que la pile débite, elle a tendance à augmenter.
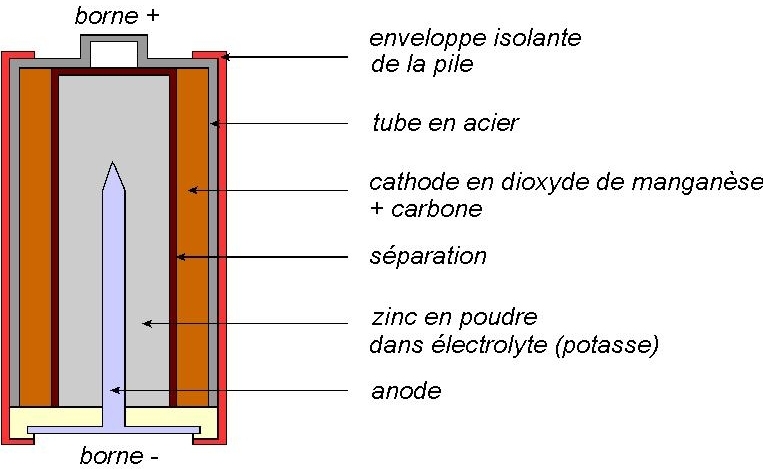
La cathode est formée par un tube en acier. Il contient du dioxyde de manganèse mélangé à du carbone. L’anode est constituée par une pointe reliée à la borne –, et entourée de poudre de zinc noyée dans un électrolyte, la potasse
Entre l’anode et la cathode se trouve une séparation qui laisse passer les ions mais empêche l’anode et la cathode de se mélanger.
Au niveau de l’anode, le zinc s’oxyde, selon la demi-équation :
Il y a libération d’électron dans le circuit électrique : l’anode est la borne –.
Au niveau de la cathode, le dioxyde de manganèse est réduit :
Les électrons sont consommés : la cathode constitue la borne +.
L’équation globale de la réaction qui a lieu dans la pile est :
Bien entendu, on peut simplifier les
La force électromotrice de la pile alcaline est de 1,5 V comme pour la pile saline. Par contre, les piles alcalines sont plus performantes : durée de vie plus longue et autorisent des courants électriques plus importants. Actuellement en France, les piles alcalines représentent environ les trois quart des ventes de piles électrochimiques.
Les batteries au plomb sont très utilisées pour cette application. Leur invention date de 1859, par Gaston Planté. Elles sont composées de plaques munies d’alvéoles. Les plaques reliées à la borne négative sont remplies de plomb poreux, sous forme de pâte, et les plaques reliées à la borne positive sont remplies de dioxyde de plomb
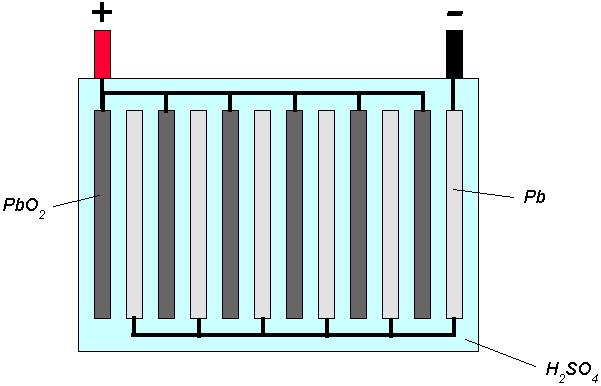
→ En décharge, le plomb au niveau de la borne – s’oxyde selon la demi-équation :
Du fait de cette réaction d’oxydation, la borne – est l’anode. Les électrons sont injectés dans le circuit électrique auquel la batterie est reliée.
Du côté de la borne +, le dioxyde de plomb est réduit :
La borne + est la cathode.
La réaction globale de décharge de la batterie s’écrit comme :
Il s’agit d’une réaction spontanée : elle peut avoir lieu sans apport d’énergie extérieur. Les couples rédox intervenant sont
→ En charge, la batterie est reliée à un générateur électrique (chargeur) : borne + du générateur sur la borne + de la batterie. Idem pour la borne –. Les ions
Au niveau de la borne –, ils sont réduits afin de redonner du plomb sous forme solide :
Le fait que la réaction soit une réduction signifie que la borne – est la cathode durant la charge de la batterie. Les électrons consommés sont ceux associés au courant électrique engendré par le chargeur.
Au niveau de la borne +, le dioxyde de plomb se reforme selon la réaction d’oxydation :
La borne + est l’anode.
→ La réaction globale de charge de la batterie est :
Cette réaction n’est pas spontanée : elle a besoin de l’énergie électrique du chargeur pour se produire. On la qualifie de réaction forcée. C’est la réaction inverse de la réaction de décharge. Ainsi, une batterie peut être chargée et déchargée plusieurs fois.
La tension entre deux plaques plomb/dioxyde de plomb est
La résistance interne r d’une batterie au plomb est très faible, de l’ordre du centième d’Ohm. L’intensité de court-circuit
Les piles alcalines emploient les mêmes réactifs que les piles saline. La réaction qui a lieu dans ces piles est
Les batteries au plomb sont un exemple d’accumulateurs électrochimiques.
• La décharge de la batterie au plomb est associée à la réaction spontanée
• En charge, la réaction qui lieu est

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








