Comment montrer que la température d'ébullition de l'eau dépend de la pression
- Fiche de cours
- Quiz
- Profs en ligne
- Videos
- Application mobile
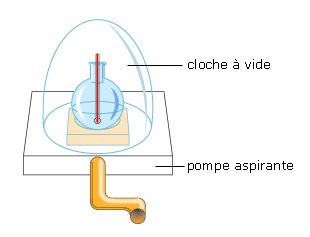
Lorsque la pression diminue, l'eau (corps pur) a une température d'ébullition inférieure à 100°C.
Afin de renouveler la même expérience, il doit noter la valeur de cette pression grâce à un baromètre (en effet, la pression dépend de l'altitude où l'on se trouve et des conditions météorologiques : un anticyclone génère des hautes pressions et une dépression, des basses pressions. La pression atmosphérique normale au niveau de la mer est égale à 1013 hPa.).
Dans les conditions de pression atmosphérique normale,
l'eau entre en ébullition à 100
°C. Si la pression diminue, la
température d'ébullition de l'eau diminue et si
la pression augmente, la température d'ébullition
augmente.
C'est ainsi qu'un alpiniste perché sur le toit de
l'Europe (4 800 mètres d'altitude) réalise
une cuisson avec une pression inférieure à 1013
hPa : l'eau va donc bouillir en dessous de 100
°C, la cuisson va être plus difficile et
beaucoup plus longue. Au contraire, s'il utilise une
« cocotte-minute », il va augmenter
artificiellement la pression. Ainsi, la température
d'ébullition va augmenter (au environ de
120°C) et la cuisson sera beaucoup plus rapide.
De manière générale, la
température d'ébullition d'un corps pur
dépend de la pression.
Ainsi, les températures d'ébullition
caractéristiques de chaque corps pur sont données
à la pression atmosphérique normale de 1013
hPa.
Plus la pression augmente et plus la température
d'ébullition augmente et inversement, si la pression
diminue, alors la température d'ébullition
diminue.
Vous avez obtenu75%de bonnes réponses !






