Dissolution d'un solide dans l'eau
- Fiche de cours
- Quiz
- Profs en ligne
- Videos
- Application mobile
Est-ce le cas de tous les solides ?
Existe t-il une limite à cette dissolution ?
Qu'advient-il du solide dissout ?
Dans cinq béchers différents contenant de l'eau, on ajoute : du sel, du sucre, du sulfate de cuivre anhydre, du sable et de la terre puis on agite.

Doc.1. Essais de dissolution de plusieurs solides.
- Bécher 1: les cristaux de sel ne sont plus visibles: le sel se dissout dans l'eau.
- Bécher 2: les cristaux de sucre ne sont plus visibles: le sucre se dissout dans l'eau.
- Bécher 3: le sulfate de cuivre anhydre colore le mélange en bleu mais ses cristaux ont disparu: le sulfate de cuivre anhydre se dissout dans l'eau.
- Bécher 4: les grains de sable se disposent rapidement au fond du récipient: le sable ne se dissout pas.
- Bécher 5: les particules de terre se dispersent dans l'eau mais restent visibles: la terre ne se dissout pas.
• Conclusion :
La dissolution d'un solide dans l'eau n'est pas toujours possible. Certains sont dits solubles (ils sont capables de se dissoudre dans l'eau), les autre sont insolubles.
L'eau salée est portée à ébullition :

Doc.2. Vaporisation de l'eau
salée.
• Observations :
L'ébullition provoque donc la vaporisation de
l'eau, mais les cristaux de sel se reforment
(doc.2.).
A cause de sa capacité à dissoudre les solides, on dit que l'eau est un solvant.
Le solide dissout est appelé soluté.
Remarque :
Une solution aqueuse peut également s'obtenir en dissolvant dans l'eau des composés gazeux et liquides.
On réalise un mélange d'eau et d'une quantité importante de sel :
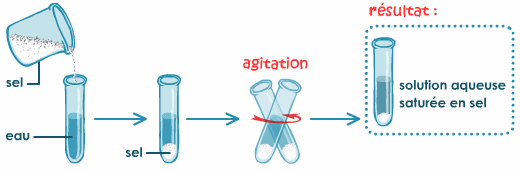
Doc.3. Saturation de l'eau en sel.
• Observations :
Après agitation, une partie du sel s'est dissoute,
mais l'autre reste sous forme de cristaux
(doc.3.).
• Interprétation
:
La solubilité du sel dans l'eau possède une
limite, l'eau ne peut pas dissoudre n'importe
quelle quantité de sel. Lorsque cette limite est
atteinte, on dit que la solution est
saturée.
• Conclusion :
Tout composé soluble ne peut se dissoudre
dans l'eau qu'en quantité limitée.
Lorsque cette limite est atteinte, on dit que la solution
est saturée. Si une quantité
supplémentaire de soluté est ajoutée
à une solution déjà
saturée, elle ne peut se dissoudre.
Remarque :
- La limite de saturation dépend du composé
à dissoudre (pour le sel elle est atteinte en
ajoutant environ 360 g à un litre d'eau et
2 000 g pour le sucre).
- La limite de saturation peut être
repoussée en chauffant le mélange.
On dit que les solides capables de se dissoudre dans l'eau sont solubles. Ceux qui ne peuvent se dissoudre dans l'eau sont insolubles.
Le liquide qui dissout un solide est appelé solvant.
Le solide qui est dissout est appelé soluté.
Le liquide obtenu après dissolution d'un corps dans l'eau est appelé solution aqueuse.
Lorsqu'un soluté ne peux plus se dissoudre, on dit que la solution est saturée.
Vous avez obtenu75%de bonnes réponses !







