L'état initial et l'état final d'un système chimique
- Fiche de cours
- Quiz
- Profs en ligne
- Videos
- Application mobile
Lorsque le chimiste étudie une transformation chimique, il
doit avant tout définir le système
qu'il étudie, c'est-à-dire toutes les
espèces chimiques mises en jeu.
Ainsi, l'étude de la réaction de l'acide
chlorhydrique sur le magnésium signifie l'étude du
système comprenant : les ions hydrogène et les
ions chlorure présents dans l'acide chlorhydrique et le
magnésium métallique.
S'il y a transformation chimique, c'est qu'au moins un réactif va se transformer en un ou plusieurs produits. Le système va donc évoluer en passant par plusieurs stades appelés états.
Au départ, il y a l'état initial, c'est-à-dire l'instant où l'on met en contact les réactifs. Lorsque la réaction n'évolue plus, c'est l'état final.
Notons que la réaction n'évolue plus si on constate
l'arrêt d'un phénomène (effervescence par
exemple, changement de couleur net...) ou si lors d'une prise de
mesure, la grandeur mesurée (pH...) n'évolue
plus.
Dans l'exemple choisi, on constate dans l'état final que
l'effervescence s'arrête avec la disparition du
magnesium si l'acide a été introduit en
quantité suffisante.
-
Les conditions
expérimentales : Les grandeurs
pression et
température
doivent être connues pour décrire l'état
des réactifs et des produits et pour pouvoir reproduire
la transformation chimique.
-
L'inventaire des
espèces : Un bilan n'est complet que
si l'inventaire de toutes les espèces chimiques en
présence est réalisé, y compris celles qui
ne réagissent pas (les ions spectateurs par
exemple).
- Le bilan de matière : Il faut pouvoir connaître la quantité de réactif mise en jeu ainsi que la quantité de produits formés. On doit en effet connaître la quantité de réactifs en excès qui reste après réaction.
Ces éléments ayant été
rassemblés on peut définir les états
initiaux et finaux du système chimique. Dans notre
exemple :
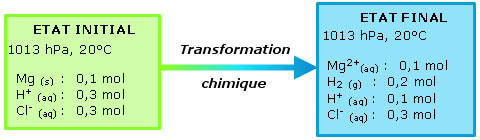
L'état d'un système regroupe les informations sur les conditions expérimentales (pression et température) et l'inventaire de toutes les espèces chimiques dans un état physique donné ainsi que leur quantité en moles.
Vous avez obtenu75%de bonnes réponses !






